প্রশ্ন-১. তড়িৎ রসায়ন কি?
উত্তর : তড়িৎ রসায়ন হলো রসায়নের একটি শাখা, যেখানে বিভিন্ন রাসায়নিক পদার্থের তড়িৎ পরিবাহী ধর্ম, তড়িৎ পরিবাহিতার প্রকারভেদ, তড়িৎ বিশ্লেষণ ও এর কার্যনীতি এবং এর সাথে জড়িত বিষয়গুলো পর্যালোচনা ও ব্যবহারিক প্রয়োগসমূহ আলোচনা করা হয়।
প্রশ্ন-২. গ্রাফাইট কী ধরনের পরিবাহী?
উত্তর : সুপরিবাহী।
প্রশ্ন-৩. কাচ, রাবার, পেট্রোল, চিনি কী ধরনের পরিবাহী?
উত্তর : অপরিবাহী।
প্রশ্ন-৪. লবণ সেতু ব্যবহারের উদ্দেশ্য কি?
উত্তর : তড়িৎ নিরপেক্ষতা বজায় রাখা।
প্রশ্ন-৫. উভমুখী তড়িৎদ্বার কয় ধরনের?
উত্তর : তিন ধরনের।
প্রশ্ন-৬. ভোল্টায়িক সেল কত সালে সর্বপ্রথম আবিষ্কার করা হয়?
উত্তর : ১৮০০ সালে সর্বপ্রথম ভোল্টায়িক সেল আবিষ্কার করা হয়।
প্রশ্ন-৭. তড়িৎ রাসায়নিক কোষ কাকে বলে?
উত্তর : যে তড়িৎ কোষে রাসায়নিক শক্তি বৈদ্যুতিক শক্তিকে রূপান্তরিত হয়, তাকে তড়িৎ রাসায়নিক কোষ বলে। যেমন- ডেনিয়েল কোষ।
প্রশ্ন-৮. সেকেন্ডারি নির্দেশক তড়িৎদ্বার কাকে বলে?
উত্তর : যে তড়িৎদ্বারের বিভব সরাসরি নির্ণয় করা যায় না, প্রাইমারি নির্দেশক তড়িৎদ্বার ব্যবহার করে নির্ণয় করা হয় তাকে সেকেন্ডারি নির্দেশক তড়িৎদ্বার বলে। যেমন– ক্যালোমোল ইলেকট্রোড।
প্রশ্ন-৯. প্রাইমারি নির্দেশক তড়িৎদ্বার কাকে বলে?
উত্তর : যে তড়িৎদ্বারের বিভব সরাসরি নির্ণয় করা যায় তাকে প্রাইমারি নির্দেশক তড়িৎদ্বার বলে। যেমনঃ প্রমাণ হাইড্রোজেন তড়িৎদ্বার।
প্রশ্ন-১০. তড়িৎ বিশ্লেষণ কী?
উত্তর : বিগলিত বা দ্রবীভূত তড়িৎ বিশ্লেষ্যের মধ্য দিয়ে বিদ্যুৎ পরিবহনের সময় সে যৌগের বিয়োজন বা রাসায়নিক পরিবর্তনকে তড়িৎ বিশ্লেষণ বলা হয়।
প্রশ্ন-১১. তড়িৎ রাসায়নিক তুল্যাঙ্ক কাকে বলে?
উত্তর : কোন তড়িৎ বিশ্লেষ্যের মধ্য দিয়ে এক কুলম্ব বিদ্যুৎ প্রবাহিত করলে বা এক অ্যাম্পিয়ার বিদ্যুৎ এক সেকেন্ড যাবৎ প্রবাহিত করলে তড়িৎদ্বারে যে পরিমাণ জমা হবে বা দ্রবীভূত হবে তাকে তড়িৎ রাসায়নিক তুল্যাঙ্ক বলে।
প্রশ্ন-১২. তড়িৎ বিশ্লেষ্য কি?
উত্তর : যে সব যৌগ বিগলিত বা পানিতে দ্রবীভূত অবস্থায় বিদ্যুৎ পরিবহন করে এবং সেই সাথে রাসায়নিক পরিবর্তন ঘটে তাদেরকে তড়িৎ বিশ্লেষ্য বলা হয়।
প্রশ্ন-১৩. তড়িৎ পরিবাহী কাকে বলে?
উত্তর : যে সমস্ত পদার্থের মধ্যদিয়ে বিদ্যুৎ প্রবাহিত হতে পারে তাকে তড়িৎ পরিবাহী বলে।
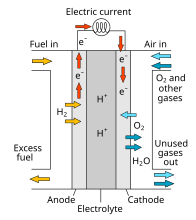
প্রশ্ন-১৪. ফুয়েল সেল কী?
উত্তর : রাসায়নিক বিক্রিয়ার মাধ্যমে বিদ্যুৎ তৈরির যান্ত্রিক কৌশলকে জ্বালানি বা ফুয়েল সেল বলে।
প্রশ্ন-১৫. কোষের তড়িচ্চালক বল কী?
উত্তর : তড়িৎ রাসায়নিক কোষের বর্তনী খোলা থাকা অবস্থায় তড়িৎদ্বার দুটির মধ্যে যে বিভব পার্থক্য হয়, তাকে কোষের তড়িচ্চালক বল (EMF) বলে। EMF এর একক ভোল্ট।
প্রশ্ন-১৬. জারণ অর্ধ বিক্রিয়া কাকে বলে?
উত্তর : জারণ-বিজারণ বিক্রিয়ার যে অংশে জারণ বিক্রিয়া ঘটে, তাকে জারণ অর্ধ বিক্রিয়া বলে।
প্রশ্ন-১৭. বিজারণ অর্ধ বিক্রিয়া কাকে বলে?
উত্তর : জারণ-বিজারণ বিক্রিয়ার যে অংশে বিজারণ বিক্রিয়া ঘটে, তাকে জারণ অর্ধ বিক্রিয়া বলে।
প্রশ্ন-১৮. ফ্যারাডের ১ম সূত্র কি?
উত্তর : তড়িৎ বিশ্লেষণের ফলে কোন তড়িৎদ্বারে সংঘটিত রাসায়নিক বিক্রিয়ার পরিমাণ তড়িৎ বিশ্লেষ্যের মধ্য দিয়ে প্রবাহিত মোট তড়িতের সমানুপাতিক।
প্রশ্ন-১৯. করোসান কি?
উত্তর : করোসান হলো ধাতুর সঙ্গে পরিবেশে উপস্থিত বস্তুসমূহের রাসায়নিক বিক্রিয়ার ফলে ধাতুর ক্ষয় হওয়ার প্রক্রিয়া।
কোটিং কাকে বলে?
উত্তর : কোন বস্তুকে পরিবেশ থেকে রক্ষা, তার গুণাগুণ ও সৌন্দর্য এবং স্থায়িত্ব ও কার্যকারিতা বৃদ্ধির জন্য, পণ্য তলে যে পাতলা প্রলেপ দেয়া হয়, তাকে আস্তরণ বা কোটিং (Coating) বলে। যেমন- রং এর কোটিং।
প্লেটিং কাকে বলে?
উত্তর : কোন ধাতব পদার্থের পণ্যকে পরিবেশ থেকে রক্ষা, দীর্ঘ স্থায়িত্ব , ক্রেতার আকর্ষণ বৃদ্ধিসহ অন্যান্য গুণাবলি বৃদ্ধি ও অর্জনের লক্ষ্যে অন্য কোন ধাতব পদার্থের সাহায্যে পণ্য পৃষ্ঠে যে প্রলেপ বা আস্তরণ দেয়া হয়, তাকে প্লেটিং (Plating) বলে।
# বহুনির্বাচনী প্রশ্ন
এক্ষেত্রে
এখানে এবং
সকল পদার্থের তড়িৎ পরিবহন ক্ষমতা এক নয়। আবার কিছু কিছু পদার্থ তড়িৎ পরিবহনই করতে পারে না। তড়িৎ পরিবহনের ক্ষমতার উপর ভিত্তি করে পদার্থসমূহকে দুই ভাগে ভাগ করা যায়। যথা :
১. তড়িৎ অপরিবাহী (Insulator) : যে সকল পদার্থের মধ্যদিয়ে তড়িৎ প্রবাহিত অর্থাৎ চলাচল করতে পারে না তাদের তড়িৎ অপরিবাহী বলা হয়। সাধারণত সমযোজী যৌগসমূহই তড়িৎ পরিবহনে অক্ষম। যেমন— কাঁচ, রাবার, চিনি, পেট্রোল ইত্যাদি। এ ছাড়া প্রায় সকল অধাতব মৌলসমূহই তড়িৎ অপরিবাহী।
২. তড়িৎ পরিবাহী (Conductor) : যে সমস্ত পদার্থের মধ্যদিয়ে তড়িৎ প্রবাহিত হতে পারে তাদের তড়িৎ পরিবাহী বলা হয়। যেমন— সকল ধাতুসমূহ, এসিড এবং ক্ষারের দ্রবণ, সকল লবণের দ্রবণ ও গ্রাফাইট, সোনা, রূপা, কপার ইত্যাদি।
তড়িৎ পরিবাহীর প্রকারভেদ (Classification of electrical conductors)
তড়িৎ পরিবহনের কৌশলের উপর নির্ভর করে তড়িৎ পরিবাহী পদার্থসমূহকে দুই ভাগে ভাগ করা যায়। যেমন :
- ধাতব পরিবাহী (Metallic Conductor ) : যে সকল তড়িৎ পরিবাহী পদার্থের মধ্যদিয়ে বিদ্যুৎ প্রবাহের সময় পদার্থের কোনোরূপ রাসায়নিক পরিবর্তন হয় না , তাদেরকে ধাতব পরিবাহী বলা হয়। সাধারণত ইলেকট্রনের প্রবাহের ফলে তড়িৎ প্রবাহিত হয় বলে ধাতব পরিবাহীসমূহকে ইলেকট্রনীয় পরিবাহীও বলা হয়। যেমন : সকল ধাতু, গ্রাফাইট (গ্রাফাইট অধাতব কঠিন মৌল হলেও সেটির মধ্য দিয়ে ইলেকট্রনের প্রবাহ ঘটে)। তাপমাত্রা বৃদ্ধির সাথে ধাতব পরিবাহীর পরিবাহীতা হ্রাস পায়। যেহেতু রাসায়নিক পরিবর্তন ঘটেনা তাই এটি ভৌত পদ্ধতি।
- তড়িৎ বিশ্লেষ্য পরিবাহী (Electrolytic Conductor) : যে সকল তড়িৎ পরিবাহী পদার্থের মধ্যদিয়ে বিদ্যুৎ প্রবাহিত করলে, পদার্থসমূহ রাসায়নিকভাবে পরিবর্তিত হয়ে নতুন ধর্ম বিশিষ্ট পদার্থে পরিণত হয় তাদের তড়িৎ বিশ্লেষ্য পরিবাহী বলা হয়। তড়িৎ বিশ্লেষ্য পদার্থসমূহ বিগলিত বা দ্রবীভূত অবস্থায় তড়িৎ পরিবহন করে এবং তড়িৎ পরিবহনের সময় পরিবাহীসমূহ বিশ্লেষিত হয়ে নতুন পদার্থে পরিণত হয়। এক্ষেত্রে ধনাত্মক ও ঋণাত্মক আয়নের মাধ্যমে তড়িৎ প্রবাহ ঘটে।
- ধনাত্মক আয়ন যে দিকে প্রবাহিত হয় তড়িৎ প্রবাহ সেদিকে এবং ঋণাত্মক আয়ন যেদিকে প্রবাহিত হয় তড়িৎ প্রবাহ তার বিপরীত দিকে ঘটে। যেহেতু তরলের মধ্য দিয়ে ক্যাটায়নগুলো ক্যাথোডে এবং অ্যানায়নগুলো অ্যানোডে যায় সেহেতু তড়িৎ বিশ্লেষ্য পদার্থের মধ্যে সর্বদা অ্যানোড থেকে ক্যাথোডে তড়িৎ প্রবাহ হয়। যেমন— সকল লবণসমূহের দ্রবণ, এসিড, ক্ষার ইত্যাদি।
তড়িৎ বিশ্লেষ্য পদার্থসমূহ আবার দুই প্রকার। যথা—
- তীব্র তড়িৎ বিশ্লেষ্য (Strong Electrolyte) : যে সকল তড়িৎ বিশ্লেষ্য পদার্থসমূহ দ্রবণে প্রায় সম্পূর্ণরূপে আয়নিত অবস্থায় থাকে তাদেরকে তীব্র তড়িৎ বিশ্লেষ্য পদার্থ বলা হয়।
- মৃদু তড়িৎ বিশ্লেষ্য (Weak Electrolyte) : যে সকল তড়িৎ বিশ্লেষ্য পদার্থ দ্রবণে আংশিক আয়নিত অবস্থায় থাকে তাদের মৃদু তড়িৎ বিশ্লেষ্য পদার্থ বলা হয়।
# বহুনির্বাচনী প্রশ্ন
ধাতব বা ইলেকট্রনীয় পরিবাহী ও তড়িৎ বিশ্লেষ্য পরিবাহীর মধ্যে পার্থক্য
ধাতব বা ইলেকট্রনীয় পরিবাহী এবং তড়িৎ বিশ্লেষ্য পরিবাহী দুটি ভিন্ন ধরনের উপাদান, যেগুলোর বৈশিষ্ট্য এবং ব্যবহার ভিন্ন। নিচে এই দুটি পরিবাহীর মধ্যে পার্থক্য আলোচনা করা হলো।
১. ধাতব বা ইলেকট্রনীয় পরিবাহী
ধাতব বা ইলেকট্রনীয় পরিবাহী এমন উপাদান যেগুলোতে বিদ্যুৎ পরিবহন প্রধানত ইলেকট্রনের মাধ্যমে হয়ে থাকে। এই ধরনের পরিবাহীতে ইলেকট্রনের পরিমাণ বেশি থাকে এবং তারা সহজেই আন্দোলন করতে পারে, যার ফলে বিদ্যুৎ চলাচল সম্ভব হয়।
- বৈশিষ্ট্য:
- এসব উপাদান সাধারণত ধাতু, যেমন তামা, অ্যালুমিনিয়াম, রৌপ্য ইত্যাদি।
- ইলেকট্রনীয় পরিবাহীরা উচ্চ তাপ পরিবাহিতা এবং নিম্ন প্রতিরোধক হয়ে থাকে।
- এই উপাদানগুলোর মধ্যে বিদ্যুৎ প্রবাহ সহজ এবং দ্রুত হয়।
- ব্যবহার:
- তামা এবং অ্যালুমিনিয়াম প্রধানত বিদ্যুৎ পরিবাহিত উপাদান হিসেবে ব্যবহৃত হয়।
- ইলেকট্রনিক্স এবং বৈদ্যুতিন যন্ত্রপাতিতে ব্যাপক ব্যবহার।
২. তড়িৎ বিশ্লেষ্য পরিবাহী
তড়িৎ বিশ্লেষ্য পরিবাহী হলো এমন উপাদান যেগুলোর মধ্যে বিদ্যুৎ প্রবাহ একটি নির্দিষ্ট আধানের মাধ্যমে চলে, এবং তাত্ত্বিকভাবে এই পরিবাহীদের বৈশিষ্ট্য হলো বিদ্যুৎ পরিবাহিতা তাদের আধানের গতির উপর নির্ভরশীল।
- বৈশিষ্ট্য:
- এসব উপাদান সাধারণত সেমিকন্ডাক্টর বা অর্ধপরিবাহী পদার্থ, যেমন সিলিকন, জার্মেনিয়াম ইত্যাদি।
- তড়িৎ বিশ্লেষ্য পরিবাহীর মধ্যে বিদ্যুৎ পরিবাহিতা তাদের তাপমাত্রা, আধানের ঘনত্ব এবং বাহ্যিক শক্তির উপর নির্ভরশীল।
- তাপমাত্রা বাড়ালে তাদের পরিবাহিতা বৃদ্ধি পায়, তবে কোনো কোনো ক্ষেত্রে মন্দে যায়।
- ব্যবহার:
- তড়িৎ বিশ্লেষ্য পরিবাহী উপাদানগুলি সেমিকন্ডাক্টর ডিভাইস, যেমন ট্রানজিস্টর, ডায়োড ইত্যাদির মধ্যে ব্যবহৃত হয়।
- এসব উপাদানগুলোর সাহায্যে বিভিন্ন বৈদ্যুতিন সিস্টেম এবং চিপ তৈরি করা হয়।
পার্থক্য
| বৈশিষ্ট্য | ধাতব বা ইলেকট্রনীয় পরিবাহী | তড়িৎ বিশ্লেষ্য পরিবাহী |
|---|---|---|
| প্রধান উপাদান | ধাতু (তামা, অ্যালুমিনিয়াম) | সেমিকন্ডাক্টর (সিলিকন, জার্মেনিয়াম) |
| বিদ্যুৎ পরিবাহিতা | উচ্চ | তাপমাত্রা এবং বাহ্যিক শক্তির উপর নির্ভরশীল |
| পরিবাহী মাধ্যম | ইলেকট্রন | আধান |
| ব্যবহার | বিদ্যুৎ পরিবহন, ইলেকট্রনিক্স | ট্রানজিস্টর, ডায়োড, সেমিকন্ডাক্টর ডিভাইস |
| প্রতিরোধকতা | কম | পরিবর্তনশীল |
সারাংশ
ধাতব বা ইলেকট্রনীয় পরিবাহী এবং তড়িৎ বিশ্লেষ্য পরিবাহী দুটি ভিন্ন ধরনের উপাদান, যেগুলোর বৈশিষ্ট্য এবং ব্যবহার ভিন্ন। ইলেকট্রনীয় পরিবাহী ধাতু ভিত্তিক এবং তড়িৎ বিশ্লেষ্য পরিবাহী সেমিকন্ডাক্টর ভিত্তিক, যেখানে বিদ্যুৎ প্রবাহের বৈশিষ্ট্য তাদের আধানের গতির উপর নির্ভরশীল।
# বহুনির্বাচনী প্রশ্ন
তড়িৎ বিশ্লেষ্যের পরিবাহিতা (Conductivity of electrolytes)
আয়নিক যৌগের জলীয় দ্রবণে অথবা গলিত অবস্থায় তড়িৎ বা বিদ্যুত পরিবহন করার ক্ষমতাকে তড়িৎ বিশ্লেষ্যের পরিবাহিতা বলে। পরিমাণগত ভাবে তড়িৎ বিশ্লেষ্যের রোধের ব্যাস্তানুপাতিক হলো ঐ তড়িৎ বিশ্লেষ্যের পরিবাহিতা। তড়িৎ বিশ্লেষ্যে পরিবাহীর মধ্য দিয়ে তড়িৎ প্রবাহিত হওয়ার কালে আয়নগুলো দ্বারা তড়িৎ বহনের বিরুদ্ধে ঐ পরিবাহী যা বাধা সৃষ্টি করে, তাকে ঐ তড়িৎ বিশ্লেষ্য পরিবাহীর রোধ বলে। যেমন কোনো তড়িৎ বিশ্লেষ্যের রোধ R এবং পরিবাহিতা L হলে, তখন L=R1
পরিবাহিতার একক : পরিবাহিতার একক =রোধের একক1
CGS পদ্ধতিতে পরিবাহিতার একক হলো ওহম−1 (ohm−1) SI পদ্ধতিতে পরিবাহিতার একক হলো সিমেন্স। সিমেন্স S প্রতীক দ্বারা প্রকাশ করা হয়। 1S=1ohm−1
- তড়িৎ বিশ্লেষ্য দ্রবণের মধ্য দিয়া তড়িৎ প্রবাহ ওহমের সূত্র মেনে চলে।
- কঠিন পরিবাহীর বেলায় রধ (resistance) যেমন পরিমাণ করা হয়, তেমনি তড়িৎ বিশ্লেষ্যের বেলায় রোধের পরিবর্তে পরিবাহিতা (conductance) পরিমাপ করা হয়।
# বহুনির্বাচনী প্রশ্ন
এন্টিমনি
ইন্ডিয়াম
এলুমিনিয়াম
কোনটিই নয়
তড়িৎ বিশ্লেষ্যের পরিবাহিতার প্রকারভেদ(Different types of conductance) :
(১) তড়িৎ বিশ্লেষ্যের আপেক্ষিক পরিবাহিতা [ Κ (Kappa) ]
(২) তড়িৎ বিশ্লেষ্যের তুল্য পরিবাহিতা Λ (Lambda) ]
(৩) তড়িৎ বিশ্লেষ্যের মোলার পরিবাহিতা [ Λm বা , μ(MU) ]
(১) তড়িৎ বিশ্লেষ্যের আপেক্ষিক পরিবাহিতা(Specific conductance of electrolytes):
1cm দূরত্বে থাকা ও 1cm2 প্রস্থচ্ছেদ বিশিষ্ট দুটি তড়িৎদ্বারের মধ্যবর্তী তড়িৎ বিশ্লেষ্য দ্রবনের রোধকে ঐ তড়িৎ বিশ্লেষ্যের আপেক্ষিক রোধ (ρ ) বলে। আপেক্ষিক রোধের বিপরীত রাশিকে আপেক্ষিক পরিবাহিতা বলা হয়।
আপেক্ষিক পরিবাহিতাকে Κ (Kappa) প্রতীক দ্বারা প্রকাশ করা হয়।
∴ আপেক্ষিক পরিবাহিতা, K=ρ1=RA1=(R1)×(A1)= দ্রবনের পরিবাহিতা × সেল ধ্রুবক
[ ∴ দ্রবণের পরিবাহিতা =R1 এবং সেল গুণাঙ্ক/ধ্রুবক =Al ]
আপেক্ষিক পরিবাহিতার একক (Unit of relative conductance):
CGS পদ্ধতিতে আপেক্ষিক পরিবাহিতা Κ এর একক =R1×Al
=রোধের এককদৈর্ঘ্যের এককক্ষেত্রফলের একক1=ওহম1×(সেমি)2সেমি=ওহম−1সেমি −1(ohm−1cm−1)
কোনো তড়িৎ বিশ্লেষ্যের এক গ্রাম তুল্যভর পরিমাণের দ্রবণকে এক সেন্টিমিটার (1cm) দুরত্বে থাকা দুটি উপযুক্ত তড়িৎদ্বারের মধ্যবর্তী স্থানে রাখলে তড়িৎ প্রবাহে দ্রবণটির যে পরিবাহিতা হয়, তাকে ঐ তড়িৎ বিশ্লেষ্যের তুল্য পরিবাহিতা বলে। তুল্য পরিবাহিতাকে Λ (Lamda) প্রতীক দ্বারা প্রকাশ করা হয়।
(২) তড়িৎ বিশ্লেষ্যের তুল্য পরিবাহিতা (Equivalent conductivity of electrolytes):
তুল্য পরিবাহিতা, Λ=ΚVeq.=Κ Vmolarতুল্য সংখ্যা (e)=Κ1C×ⅇ=Κ1000C×ⅇ
[C এর একক mol L-1 হলে]
Λ=κ×Veq.=κ× তুল্য সংখ্যা (e)Vmolar =κ×C×e1=κ×C×e1000
তুল্য পরিবাহিতার একক(Unit of equivalent conductivity):
Λ=κ×Veq=ohm−1 cm−1×cm3( g− equiv )−1=ohm−1 cm2( g− equiv )−1
(৩) তড়িৎ বিশ্লেষ্যের মোলার পরিবাহিতা(Molar conductivity of electrolytes):
কোনো তড়িৎ বিশ্লেষ্যের এক মোল পরিমাণের দ্রবণকে এক সেন্টিমিটার (1cm) দুরত্বে থাকা দুটি উপযুক্ত তড়িৎদ্বারের মধ্যবর্তী স্থানে রাখলে তড়িৎ প্রবাহে দ্রবণটির যে পরিবাহিতা হয়, তাকে ঐ তড়িৎ বিশ্লেষ্যের মোলার পরিবাহিতা বলে। মোলার পরিবাহিতাকে Λmপ্রতীক দ্বারা প্রকাশ করা হয়। V আয়তনের দ্রবণে এক মোল তড়িৎ বিশ্লেষ্য থাকলে মোলার পরিবাহিতা ও আপেক্ষিক পরিবাহিতার মধ্যে নিম্নরূপ সম্পর্ক হয়:
Λm=κ×VMolar [Vmolar = ঘনমাত্রা (C)1]
মোলার পরিবাহিতার একক(Unit of molar conductivity):
∴Λm এর একক =kappa এরএকক×ঘনমাত্রার একক 1=Ohm−1 cm−1× cm3 mol1
আপেক্ষিক পরিবাহিতা, κ=ρ1=(R1)×(A1)
তুল্য পরিবাহিতা, Λ=κ× তুল্য সংখ্যা Vmolar
মোলার পরিবাহিতা, Λm=κ×VMolar
3.5cm2 কার্যকর ক্ষেত্রফল এবং 0.6cm পারস্পরিক দুরত্বে রাখা দুটি তড়িৎদ্বারে মধ্যে 0.5 M H2SO4 দ্রবণ রাখলে সিস্টেমটির বৈদ্যুতিক রোধ 520ohm পাওয়া যায়। তাহলে, দ্রবণটির আপেক্ষিক তুল্য এবং মোলার পরিবাহিতা নির্ণয় কর।(If 0.5M H2SO4 solution is kept between two electrodes with an effective area of 3.5cm2 and 0.6m distance, we get 520 ohm electrical resistance. Define the relative equivalent conductivity and molar conductivity of the solution.)
Solution: আপেক্ষিক পরিবাহিতা =ρ1=R1⋅ A1=κ( kappa )
∴K=5201×3.50.6ohm−1 cm−1=3.2967×10−4ohm−1 cm−1(Ans.)
তুল্য পরিবাহিতা নির্ণয়ের ক্ষেত্রে,
0.5 M H2SO4 দ্রবণ মানে 1000cm3 দ্রবণে 0.5 mole বা 49g H2SO4 বা H2SO4 এর একক তুল্যভর বিদ্যমান।
তাহলে, Veq=1000 cm3
∴ তুল্য পরিবাহিতা =Λ=κVeq=(3.2967×10−4×1000)ohm−1 cm2( g.equiv )−1
=0.32967ohm−1 cm2 (g.equiv) −1(Ans.)
মোলার পরিবাহিতা নির্ণয়ের ক্ষেত্রে, 0.5 mole H2SO4 আছে 1000 cm3 এ
1 mole H2SO4 আছে 2000cm3 এ
∴ Vmolar =2000 cm3
∴ মোলার পরিবাহিতা =μ=κVmolar =0.65934ohm−1 cm2 mole −1
# বহুনির্বাচনী প্রশ্ন
তড়িৎ বিশ্লেষ্যের ঘনমাত্রা পরিবর্তনে তুল্য পরিবাহীতার পরিবর্তন
তড়িৎ বিশ্লেষণে, একটি উপাদানের তুল্য পরিবাহিতা তার বৈদ্যুতিক পরিবাহিতা সূচক যা উপাদানের বৈদ্যুতিক প্রবাহের জন্য সহায়ক। তুল্য পরিবাহিতা \( \sigma \) সাধারণত ঘনমাত্রা (density) পরিবর্তনের সাথে সম্পর্কিত থাকে, যা উপাদানের বৈদ্যুতিক পরিবাহিতা এবং ঘনমাত্রার মধ্যে সম্পর্ক স্পষ্ট করে।
তুল্য পরিবাহিতার সংজ্ঞা
তুল্য পরিবাহিতা \( \sigma \) হচ্ছে একটি উপাদানের বৈদ্যুতিক পরিবাহিতা (conductivity) যা ইউনিট দৈর্ঘ্য এবং একক আয়তনের জন্য নির্ধারিত। এটি একটি উপাদানের বৈদ্যুতিক পরিবাহিতার ক্ষমতা প্রকাশ করে এবং এর একক হল \( \text{S/m} \) (সিমেন্স প্রতি মিটার)।
ঘনমাত্রার প্রভাব
তুল্য পরিবাহিতা ঘনমাত্রার উপর নির্ভরশীল হয়। সাধারণত, যতো বেশি ঘনমাত্রা, ততো বেশি আধান বা আধান বাহক (charge carrier) উপাদানে উপস্থিত থাকে, যার ফলে পরিবাহিতা বৃদ্ধি পায়। তবে, এই সম্পর্ক নির্ভর করে উপাদানের ধরণ, তাপমাত্রা এবং অন্যান্য রাসায়নিক অবস্থার উপর।
- নন-ধাতু উপাদান: নন-ধাতু উপাদানগুলোর জন্য ঘনমাত্রা বাড়ানোর সাথে পরিবাহিতা বৃদ্ধি পায়, কিন্তু এক নির্দিষ্ট সীমার পর এটি কমে যেতে পারে কারণ উচ্চ ঘনমাত্রায় আধান বাহকরা একে অপরকে বাধা দিতে পারে।
- ধাতু উপাদান: ধাতু উপাদানগুলোর ক্ষেত্রে, ঘনমাত্রা বৃদ্ধির সাথে পরিবাহিতা সাধারণত হ্রাস পায়, কারণ উপাদানে অধিক আধান বাহক সংঘর্ষ সৃষ্টি করে এবং এর ফলে পরিবাহিতা কমে যায়।
তাপমাত্রা ও পরিবাহিতার সম্পর্ক
তাপমাত্রাও তুল্য পরিবাহিতার উপর প্রভাব ফেলে। অধিকাংশ উপাদানে, তাপমাত্রা বৃদ্ধি পেলে আধান বাহকগুলো দ্রুতগতিতে চলাচল করে, যার ফলে পরিবাহিতা বৃদ্ধি পায়। তবে, ধাতু উপাদানে এই প্রভাব সীমিত হতে পারে, কারণ তাপমাত্রার বৃদ্ধির সাথে ধাতুর আণবিক সংকোচন ঘটে, যা পরিবাহিতাকে কমিয়ে দেয়।
সারাংশ
তুল্য পরিবাহিতার পরিবর্তন এবং ঘনমাত্রার সম্পর্ক অত্যন্ত জটিল এবং উপাদানের ধরণ ও পরিবেশগত অবস্থার উপর নির্ভর করে। সাধারণত, ঘনমাত্রা এবং পরিবাহিতার মধ্যে একটি সম্বন্ধ থাকে, তবে এর পরিপূর্ণ বিশ্লেষণ উপাদানের ভৌত বৈশিষ্ট্য ও তাপমাত্রার উপর নির্ভরশীল।
পরিবাহিতা নির্ণয়ে ব্যবহৃত পরিবাহিতা কোষ ও কোষ ধ্রুবক
পরিবাহিতা (conductivity) হলো একটি দ্রবণের বৈদ্যুতিক প্রবাহ চালানোর ক্ষমতা। এটি দ্রবণের মধ্যে আয়নাগুলির উপস্থিতি ও তাদের গতি দ্বারা নির্ধারিত হয়। পরিবাহিতা নির্ণয়ের জন্য বিশেষ ধরনের পরিবাহিতা কোষ (conductivity cell) ব্যবহৃত হয়, যা দ্রবণের বৈদ্যুতিক পরিবাহিতা মাপতে সাহায্য করে।
পরিবাহিতা কোষ
পরিবাহিতা কোষ একটি বৈদ্যুতিক সার্কিটের অংশ, যা দুইটি ইলেকট্রোড দ্বারা তৈরি হয় এবং এই ইলেকট্রোডের মধ্য দিয়ে দ্রবণ চলাচল করে। কোষটি সাধারণত লম্বা ও সংকীর্ণ আকারের হয়ে থাকে, যাতে ইলেকট্রোডগুলি দ্রবণের সাথে প্রাকৃতিকভাবে যোগাযোগ স্থাপন করে।
এলেকট্রোড দুইটি সাধারণত সিলভার (Ag) অথবা প্লাটিনাম (Pt) দিয়ে তৈরি হয়, এবং দ্রবণটি ঐ ইলেকট্রোডের মধ্যে দিয়ে বৈদ্যুতিক প্রবাহ প্রবাহিত হতে পারে। যখন বিদ্যুৎ প্রবাহিত হয়, তখন দ্রবণের আয়নাগুলি চার্জ বহন করে এবং এটি বৈদ্যুতিক পরিবাহিতা সৃষ্টি করে।
কোষ ধ্রুবক
কোষ ধ্রুবক (cell constant) পরিবাহিতা কোষের একটি মৌলিক গুণ, যা কোষের আকার এবং গঠন দ্বারা নির্ধারিত হয়। কোষ ধ্রুবক সাধারণত k দ্বারা চিহ্নিত করা হয় এবং এটি কোষের দুইটি ইলেকট্রোডের মধ্যে দৈর্ঘ্য ও ক্ষেত্রফল দ্বারা সম্পর্কিত। এটি একটি পরিমাণ যা পরিবাহিতাকে নির্ধারণ করতে ব্যবহৃত হয়।
কোষ ধ্রুবকের মান নির্ণয় করা হয় এই সূত্র দ্বারা:

এখানে,
- \(d\) = ইলেকট্রোডগুলির মধ্যে দূরত্ব
- \(A\) = ইলেকট্রোডের পরিসর (যেমন, একক ক্ষেত্রফল)
পরিবাহিতা নির্ণয়ের জন্য, কোষ ধ্রুবক ব্যবহার করে পরিমাপ করা যেতে পারে এবং এটি বিভিন্ন দ্রবণের জন্য আলাদা হতে পারে।
পরিবাহিতা মাপার পদ্ধতি
পরিবাহিতা নির্ণয়ের জন্য সঠিক পরিবাহিতা কোষ এবং তার কোষ ধ্রুবক ব্যবহার করতে হয়। কোষ ধ্রুবক যখন জানা থাকে, তখন পরিবাহিতা নির্ণয় করা হয় নিম্নলিখিত সূত্র দ্বারা:
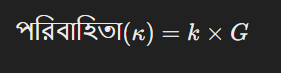
এখানে,
- \(k\) = কোষ ধ্রুবক
- \(G\) = দ্রবণের গ্যাডি (conductance), যা মাপা হয় কোষে প্রবাহিত বিদ্যুৎ দ্বারা।
এই পদ্ধতিতে পরিবাহিতা নির্ণয় করা হয়, যা রাসায়নিক বিশ্লেষণ এবং গুণগত পরীক্ষা গুলোতে গুরুত্বপূর্ণ ভূমিকা পালন করে।
সারাংশ
পরিবাহিতা কোষ এবং কোষ ধ্রুবক পরিবাহিতা নির্ণয়ের জন্য অপরিহার্য উপাদান। কোষ ধ্রুবকের মাধ্যমে আমরা দ্রবণের বৈদ্যুতিক পরিবাহিতা নির্ধারণ করতে পারি এবং এটি বিভিন্ন রাসায়নিক এবং শিল্প কাজের ক্ষেত্রে ব্যবহার করা হয়।
তড়িৎ বিশ্লেষণের পরিবাহিতা মাপা (Measurement of Electrical Conductivity):
তড়িৎ বিশ্লেষণের পরিবাহিতা (Electrical conductivity) হলো এক ধরনের বৈদ্যুতিক সম্পত্তি যা কোনো উপাদানের বৈদ্যুতিক প্রবাহ চলার ক্ষমতাকে নির্দেশ করে। এটি একটি পদার্থের আণবিক গঠন এবং তার মধ্যে বিদ্যুৎ প্রবাহের প্রবণতার উপর নির্ভরশীল। পরিবাহিতা নির্ধারণের জন্য, পরিবাহিতা পরীক্ষক বা কন্ডাকটিভিটি মিটার ব্যবহার করা হয়, যা একটি নির্দিষ্ট তরল বা উপাদানের মধ্য দিয়ে প্রবাহিত বৈদ্যুতিক প্রবাহ পরিমাপ করে।
পরিবাহিতা মাপার প্রক্রিয়া:
- পরীক্ষণ কক্ষ নির্বাচন:
পরিবাহিতা মাপার জন্য একটি নির্দিষ্ট পরীক্ষণ কক্ষ নির্বাচন করা হয়, যেমন পানির জন্য বিশেষভাবে তৈরি কন্ডাকটিভিটি মিটার ব্যবহৃত হয়। - পরীক্ষণ কক্ষের প্রস্তুতি:
পরীক্ষণের পূর্বে সংশ্লিষ্ট তরল বা পদার্থকে পরিষ্কার এবং প্রস্তুত করতে হবে যাতে কোনো বাইরের অমেধ্য বা মিথ্যা পরিবাহিতা মাপের ক্ষেত্রে বিভ্রাট সৃষ্টি না হয়। - পরিবাহিতা মিটার সেটআপ:
পরিবাহিতা মিটার দুটি ইলেকট্রোড ব্যবহার করে তরলের মধ্যে বৈদ্যুতিক প্রবাহ চালনা করে। প্রবাহের বিপরীতে প্রতিরোধকের মান থেকে পরিবাহিতা নির্ধারণ করা হয়। - ডেটা সংগ্রহ:
মিটারটি তরল বা উপাদানের মাধ্যমে বৈদ্যুতিক প্রবাহ প্রেরণ করে এবং পরবর্তী ডিভাইসে গতি, ভোল্টেজ এবং বর্তমান পরিমাপ করে পরিবাহিতার মান হিসাব করে। গণনা:
এরপরে, সূত্র ব্যবহার করে পরিবাহিতার মান নির্ধারণ করা হয়। সাধারণত, পরিবাহিতা (κ) পরিমাপের জন্য ব্যবহৃত সূত্র হলো:\[
\kappa = \frac{1}{R} \times \frac{l}{A}
\]যেখানে,
- \( R \) হলো প্রতিরোধক,
- \( l \) হলো ইলেকট্রোডের মধ্যে পরিসরের দৈর্ঘ্য,
- \( A \) হলো ইলেকট্রোডের প্রস্থ।
এটির গুরুত্ব:
পরিবাহিতা মাপা কেমিক্যাল সলিউশনের বিশ্লেষণ, পানির গুণগত মান পরীক্ষা, দূষণ নির্ধারণ এবং অন্যান্য বৈদ্যুতিন গবেষণার ক্ষেত্রে অত্যন্ত গুরুত্বপূর্ণ।
# বহুনির্বাচনী প্রশ্ন
তড়িৎ বিশ্লেষণের পরিবাহিতা
তড়িৎ বিশ্লেষণ একটি শাখা যা বিদ্যুৎ ও তার সম্পর্কিত বিষয়াবলী বিশ্লেষণ করে এবং বিভিন্ন বৈদ্যুতিন সিস্টেমের কার্যক্ষমতা এবং আচরণ বুঝতে সাহায্য করে। এর মধ্যে পরিবাহিতা (Conductance) একটি গুরুত্বপূর্ণ মৌলিক ধারণা। পরিবাহিতা একটি পদার্থের বৈশিষ্ট্য, যা এটি বৈদ্যুতিক স্রোত বা তড়িৎ প্রবাহকে কতটা সহজে পরিবহন করতে পারে তা নির্দেশ করে।
পরিবাহিতা হল প্রতিরোধ (Resistance) এর পরিপন্থী পরিমাণ এবং এটি সিমেন্স (Siemens) ইউনিটে পরিমাপ করা হয়। এর গাণিতিক সম্পর্ক হচ্ছে:
\[
G = \frac{1}{R}
\]
যেখানে,
- \(G\) হল পরিবাহিতা,
- \(R\) হল প্রতিরোধ।
যত বেশি পরিবাহিতা, তত কম প্রতিরোধ এবং তত সহজে বৈদ্যুতিক প্রবাহ প্রবাহিত হয়। সাধারণত পরিবাহিতার পরিমাণ একটি পদার্থের পরিবাহী বৈশিষ্ট্য ও তার আকার-আয়তনের উপর নির্ভর করে।
পরিবাহিতার গাণিতিক বিশ্লেষণ
তড়িৎ বিশ্লেষণের মধ্যে, পরিবাহিতা গাণিতিকভাবে হিসাব করা হয়:
\[
G = \frac{I}{V}
\]
এখানে,
- \(I\) হল বিদ্যুৎ প্রবাহের পরিমাণ (অ্যাম্পিয়ার),
- \(V\) হল ভোল্টেজ (ভোল্ট)।
এই সূত্রের মাধ্যমে আমরা জানাতে পারি, বিদ্যুৎ প্রবাহের জন্য পরিবাহিতা কীভাবে একটি সিস্টেমের সামগ্রিক আচরণকে প্রভাবিত করে। উচ্চ পরিবাহিতা তড়িৎ প্রবাহকে সহজতর করে, যার ফলে কম ভোল্টেজের প্রয়োগে বেশি প্রবাহ পাওয়া যায়।
পরিবাহিতা এবং অন্যান্য বৈশিষ্ট্য
একটি পদার্থের পরিবাহিতা তার সংকেত প্রবাহ, তাপ পরিবহন এবং অন্যান্য বৈশিষ্ট্যগুলির সাথে সম্পর্কিত। সাধারণত ধাতু, গ্রাফাইট এবং অন্যান্য পরিবাহী পদার্থের পরিবাহিতা বেশি থাকে, যা তড়িৎ প্রবাহের জন্য উপযুক্ত।
সারাংশ
পরিবাহিতা একটি গুরুত্বপূর্ণ বৈশিষ্ট্য যা তড়িৎ বিশ্লেষণে গুরুত্বপূর্ণ ভূমিকা পালন করে। এটি একটি পদার্থের বৈদ্যুতিক পরিবাহিতার ক্ষমতা নির্দেশ করে এবং তার উপর নির্ভর করে সিস্টেমের কার্যক্ষমতা ও দক্ষতা।
তড়িৎ বিশ্লেষণে ব্যবহৃত প্রধান কিছু পদ এবং তাদের এককগুলো নিম্নরূপ:
১. তড়িৎ প্রবাহ (Electric Current)
- সংজ্ঞা: তড়িৎ প্রবাহ হলো সেই পরিমাণ বৈদ্যুতিন পার্থক্য, যা একক সময়ের মধ্যে নির্দিষ্ট এলাকা দিয়ে প্রবাহিত হয়।
- একক: অ্যাম্পিয়ার (Ampere, A)
২. ভোল্টেজ (Voltage)
- সংজ্ঞা: ভোল্টেজ হলো দুটি পয়েন্টের মধ্যে বৈদ্যুতিন শক্তির পার্থক্য বা বৈদ্যুতিন চাপ।
- একক: ভোল্ট (Volt, V)
৩. প্রতিরোধ (Resistance)
- সংজ্ঞা: প্রতিরোধ হলো একটি উপাদানের বৈদ্যুতিন প্রবাহের প্রতিরোধ ক্ষমতা।
- একক: ওহম (Ohm, Ω)
৪. শক্তি (Power)
- সংজ্ঞা: শক্তি হলো একক সময়ের মধ্যে কাজের পরিমাণ বা শক্তির হারের পরিমাণ।
- একক: ওয়াট (Watt, W)
৫. শক্তি প্রাচুর্য (Energy)
- সংজ্ঞা: শক্তি প্রাচুর্য হলো যেকোনো সিস্টেমে সঞ্চিত শক্তির পরিমাণ।
- একক: জুল (Joule, J)
৬. ধারাবাহিকতা (Capacitance)
- সংজ্ঞা: ধারাবাহিকতা হলো দুটি পৃষ্ঠের মধ্যে বৈদ্যুতিন চার্জ সঞ্চয়ের ক্ষমতা।
- একক: ফ্যারাড (Farad, F)
৭. চুম্বকত্ব (Inductance)
- সংজ্ঞা: চুম্বকত্ব হলো যেকোনো পরমাণু বা উপাদানের বৈদ্যুতিন প্রবাহে চুম্বকীয় শক্তির সঞ্চয়ের ক্ষমতা।
- একক: হ্যানরি (Henry, H)
৮. ভোল্টেজের তড়িৎ গতিসীমা (Electric Field)
- সংজ্ঞা: এটি বৈদ্যুতিন পার্থক্যের ফলে সৃষ্ট একটি শক্তির ক্ষেত্র, যা চার্জগুলোকে প্রভাবিত করে।
- একক: ভোল্ট প্রতি মিটার (Volt per meter, V/m)
৯. চুম্বকীয় ক্ষেত্র (Magnetic Field)
- সংজ্ঞা: চুম্বকীয় ক্ষেত্র হলো এক ধরনের শক্তির ক্ষেত্র, যা চুম্বকীয় পদার্থের মধ্যে তৈরি হয়।
- একক: টেসলা (Tesla, T)
১০. তড়িৎ পরিবাহিতা (Electric Conductivity)
- সংজ্ঞা: এটি একটি পদার্থের বৈদ্যুতিন প্রবাহ চলার ক্ষমতা।
- একক: সিমেন্স (Siemens, S)
সারাংশ
তড়িৎ বিশ্লেষণে ব্যবহৃত প্রধান পদ যেমন তড়িৎ প্রবাহ, ভোল্টেজ, প্রতিরোধ, শক্তি, শক্তি প্রাচুর্য, ধারাবাহিকতা, চুম্বকত্ব, বৈদ্যুতিন ক্ষেত্র, চুম্বকীয় ক্ষেত্র এবং তড়িৎ পরিবাহিতা তাদের নিজ নিজ একক নিয়ে বিশ্লেষিত হয়। এগুলোর সঠিক ব্যবহার এবং মাপের মাধ্যমে বৈদ্যুতিন সিস্টেমের কার্যকারিতা বুঝে নেওয়া যায়।
তড়িৎ বিশ্লেষণ ও ফ্যারাডের সূত্র (Electrolysis and Faraday’s Law)
প্রশ্নঃ ইলেক্ট্রনীয় পরিবাহী এবং ইলেকট্রোলাইটিক পরিবাহীর মধ্যে পার্থক্য লিখ। অথবা, ধাতব পরিবাহী এবং তড়িৎ বিশ্লেষ্যের মধ্যে পার্থক্য লিখ ।(Q. Write the difference between electronic conductor and electrolytic conductor. Or, write the difference between metalic conductor and electrolytic analysis)
উত্তরঃ
ধাতব পরিবাহী এবং তড়িৎ বিশ্লেষ্যের মধ্যে পার্থক্যঃ
| ধাতব পরিবাহী | তড়িৎ বিশ্লেষ্য পরিবাহী |
| ইলেকট্রন প্রবাহের ফলে তড়িৎ প্রবাহ সৃষ্টি হয়। অণু পরমাণুর স্থানান্তর হয় না। | আয়নের চলাচলে তড়িৎ পরিবাহিতা ঘটে। |
| তড়িৎ প্রবাহের সময় রাসায়নিক বিক্রিয়া ঘটে না। শুধুমাত্র তাপের উদ্ভব ঘটে। এটি ভৌত পরিবর্তন। | তড়িৎ প্রবাহের ফলে রাসায়নিক বিক্রিয়া ঘটে এবং তাপের উদ্ভব ঘটে। |
| ইলেক্ট্রন প্রবাহের বিপরীত দিককে বিদ্যুৎ প্রবাহের দিক হিসেবে ধরে নেয়া হয়। | তড়িৎ প্রবাহ ঘটে অ্যানোড থেকে ক্যাথোডের দিকে। |
| তাপমাত্রা বৃদ্ধির ফলে পরিবাহিতা হ্রাস পায়। কারণ এর ফলে রোধ বৃদ্ধি পায়। | তাপমাত্রা বৃদ্ধির ফলে পরিবাহিতা বৃদ্ধি পায়। |
| চাপের কোন প্রভাব নেই। | বাহ্যিক চাপ বাড়লে পরিবাহিতা বৃদ্ধি পায়। |
| ওহ্মের সূত্র প্রযোজ্য। | ফ্যারাডের সূত্র প্রযোজ্য। |
প্রশ্নঃ তড়িৎ বিশ্লেষণ, অ্যানোড (জারণ ঘটে) ও ক্যাথোড (বিজারণ ঘটে) বলতে কী বুঝ?(What is electrolysis, anode and cathode?)
উত্তরঃ
তড়িৎ বিশ্লেষণ (Electrolysis): যে প্রক্রিয়ায় বিগলিত বা কোন উপযুক্ত দ্রাবকে দ্রবীভূত অবস্থার কোন তড়িৎ বিশ্লেষ্য পদার্থের মধ্য দিয়ে বিদ্যুৎ প্রবাহের ফলে সেই যৌগের বিয়োজনের মাধ্যমে রাসায়নিক বিক্রিয়া সংঘটিত হয় তাকে তড়িৎ বিশ্লেষণ বলে।
অ্যানোড ও ক্যাথোড (Anode and Cathode): দুটি তড়িৎদ্বারের মধ্যে যে তড়িৎদ্বারে জারণ ঘটে তাকে অ্যানোড এবং যে তড়িৎদ্বারের বিজারণ ঘটে তাকে ক্যাথোড বলে।
প্রশ্নঃ বিশুদ্ধ পানি ও বিশুদ্ধ HCI তড়িৎবিশ্লেষ্য নয় কিন্তু এই দুটির মিশ্রণ তীব্র তড়িৎ বিশ্লেষ্য পদার্থ কেন?(Pure water and pure HCl are not electrolyte but why is the mixture of these two strong-electrolyte?)
উত্তরঃ
কোনো তড়িৎ বিশ্লেষ্যের মধ্যে আয়নের উপস্থিত আবশ্যিক । বিশুদ্ধ পানিতে খুব সামান্য পরিমাণ H+ ও OH− আয়ন থাকে বলে বিশুদ্ধ পানি তড়িৎ পরিবহন করে না। তাই বিশুদ্ধ পানি তড়িৎ বিশ্লেষ্য নয়। অনুরূপভাবে, বিশুদ্ধ HCl সমযোজী যৌগ বলে বিশুদ্ধ HCl ও তড়িৎ পরিবহন করে না । HCl একটি পোলার সমযোজী যৌগ।
কিন্তু পানির মধ্যে বিশুদ্ধ HCl যোগ করলে পোলার HCl অণু, পানির অণুর দ্বারা দ্রাবকায়িত হয়ে স্থায়ী H3O+ ও CI− আয়ন সৃষ্টি করে।
ফলে দ্রবণ [HCl+H2O⇋H3O++CI−] উত্তম পরিবাহী হয়। এ কারণে HCl এর জলীয় দ্রবণ তড়িৎ বিশ্লেষ্য পদার্থ।
প্রশ্ন: লঘু NaCl দ্রবণ, লঘু CH3COOH দ্রবণ, লঘু HCl দ্রবণ ও লঘু চিনির দ্রবণের পরিবাহিতার ক্রম এর ব্যাখ্যা কর। (Explain the order of conductivity of light NaCl solution, light CH₃COOH, light HCl solution and light sugar solution.)
উত্তর:
লঘু HCl ও লঘু NaCl তীব্র তড়িৎ বিশ্লেষ্য পদার্থ। এরা দ্রবণে সম্পূর্ণ বিয়োজিত হয়। CH3COOH একটি দুর্বল তড়িৎ বিশ্লেষ্য পদার্থ। দ্রবণে এর অধিকাংশ অণু অবিয়োজিত অবস্থায় থাকে। চিনি একটি তড়িৎ অবিশ্লেষ্য পদার্থ। আবার H+ আয়নের তড়িৎ পরিবাহিতা অন্যান্য আয়ন থেকে অনেক বেশি বলে উপযুক্ত পদার্থগুলির তড়িৎ পরিবাহিতার উর্ধ্বক্রম। চিনির লঘু দ্রবণ < CH3COOH এর লঘু দ্রবণ < NaCl এর লঘু দ্রবণ < HCl এর লঘু জলীয় দ্রবণ।
প্রশ্নঃ 0.1M NH4OH অপেক্ষা 0.1M NaOH দ্রবণের তড়িৎ পরিবাহীতা বেশি কেন?(Why is the electric conductivity of 0.1M NaOH higher than that of 0.1M NH₄OH?)
উত্তরঃ
NaOH তীব্র তড়িৎ বিশ্লেষ্য পদার্থ, তাই 0.1M দ্রবণে এটি প্রায় সম্পূর্ণরূপে বিয়োজিত হয়ে Na+ ও OH− আয়ন উৎপন্ন করে। কিম্ভ NH4OH মৃদু তড়িৎ বিশ্লেষ্য, তাই 0.1M দ্রবণে এটি আংশিকভাবে বিয়োজিত হয়। সুতরাং, একই আয়তনের 0.1M NHOH দ্রবণ অপেক্ষা 0.1M NaOH দ্রবণে অনেক বেশি সংখ্যক আয়ন থাকে। আয়নের সংখ্যাজনিত কারণে NH4OH দ্রবণ অপেক্ষা NaOH দ্রবণের পরিবাহিতা অনেক বেশি হবে।
প্রশ্নঃ তড়িৎ বিশ্লেষণ একটি জারণ বিজারণ প্রক্রিয়া ব্যাখ্যা কর। (Explain-“Electrolysis is an Oxidation-Reduction process”.)
উত্তরঃ
তড়িৎ বিশ্লেষণের সময় ক্যাটায়ন ক্যাথোড হতে এক বা একাধিক ইলেকট্রন গ্রহণ করে অর্থাৎ তা বিজারিত হয়। অপরদিকে অ্যানায়ন অ্যানোডে এক বা একাধিক ইলেকট্রন দান করে তা জারিত হয়। যেমন- তরলিত NaCl এর তড়িৎ বিশ্লেষণকালে নিম্নোক্ত বিক্রিয়া ঘটে-
NaCl(l)→Na+(l)+Cl−(l)
অ্যানোড (Anode): 2Cl−(l)→Cl2( g)+2e−
ক্যাথোড (Cathode): 2Na+(l)+2e−→2Na(s)
উপরোক্ত বিক্রিয়া হতে দেখা যায় যে, ইলেকট্রন দানের মাধ্যমে অ্যানোডে জারণ, ইলেকট্রন গ্রহনের মাধ্যমে ক্যাথোডে বিজারণ ঘটে। তাই তড়িৎ বিশ্লেষণ একটি জারণ বিজারণ প্রক্রিয়া।
প্রশ্ন : তড়িৎ বিশ্লেষণ যে সমস্ত বিষয়ের উপর নির্ভরশীল তা ব্যাখ্যা কর। (Explain the factors electrolysis depends on.)
উত্তরঃ
নিম্নোক্ত তিনটি বিষয়ের উপর নির্ভর করে।
যেমন-
১। তড়িৎ রাসায়নিক সারিতে আয়নের অবস্থান (Position of ions in electrochemical series): তড়িৎ বিশ্লেষণের সময় বিভিন্ন আয়নের চার্জমুক্ত হওয়ার প্রবণতার উপর ভিত্তি করে আয়নসমূহকে যে সারিতে সাজানো হয়েছে তাকে তড়িৎ রাসায়নিক সারি বলে। এ সারিতে যে আয়নের অবস্থান যত নিচে সে আয়নের চাজমুক্ত হওয়ার প্রবণতা তত বেশি । যেমন- কোন দ্রবণে Na+ এবং K+ উপস্থিত থাকলে Na+ চার্জমুক্ত হবে আগে ।
২। সমধর্মী আয়নের ঘনমাত্রার প্রভাব (Effect of the concentration of homogenous ions): তড়িৎ রাসায়নিক সারিতে কোন আয়নের অবস্থানের অগ্রাধিকারের চেয়ে ঐ আয়নের ঘনমাত্রার প্রভাব বেশি কার্যকরী। যেমন- 0.1M NaCl এর জলীয় দ্রবণে OH− এর ঘনমাত্রা 10−7molL−1 এর CI– এর ঘনমাত্রা 0.1molL−1 । তড়িৎ রাসায়নিক সারি অনুযায়ী OH− আয়ন আগে চার্জমুক্ত হওয়া উচিত। কিন্তু Cl− এর ঘনমাত্রা বেশী হওয়ায় এটি আগে চার্জমুক্ত হবে।
৩। তড়িৎদ্বারের প্রকৃতি (Nature of electrodes): তড়িৎদ্বারের প্রকৃতি অনেক সময় তড়িৎ রাসায়নিক সারির ব্যতিক্রম ঘটায়। যেমন- NaCl এর জলীয় দ্রবণে প্লাটিনাম তড়িৎদ্বার ব্যবহৃত হলে সক্রিয়তা সিরিজ মতে H+ চার্জমুক্ত হয় কিন্তু মার্কারী তড়িৎদ্বার ব্যবহৃত হলে Na+ আগে চার্জযুক্ত হয়।
প্রশ্ন : ফ্যারাডের তড়িৎ বিশ্লেষণের সূত্র দুটি বিবৃত ও ব্যাখ্যা কর।(State and explain Faraday’s two laws of electrolysis.)
উত্তরঃ
ফ্যারাডের প্রথম সূত্র (Faraday’s 1st Law): তড়িৎ বিশ্লেষণকালে যে কোন তড়িৎদ্বারে সংঘঠিত রাসায়নিক বিক্রিয়ার পরিমাণ অর্থাৎ কোনো তড়িৎদ্বারে সঞ্চিত বা দ্রবীভূত পদার্থের পরিমাণ প্রবাহিত বিদ্যুতের বা চার্জের পরিমাণের সমানুপাতিক।
এ সূত্র মতে,
W∝Q
W=ZQ
W=ZIt(Q=It)
[ Q= প্রবাহিত চার্জের পরিমাণ, W= সঞ্চিত বা দ্রবীভূত পদার্থের পরিমাণ ]
এখানে, Z হল তড়িৎ রাসায়নিক তুল্যাঙ্ক-
যদি I=1amp এবং t=1s হয় তাহলে,
Z=Wgmc−1 অর্থাৎ তড়িৎ বিশ্লেষ্যের মধ্য দিয়ে 1c পরিমাণ বিদ্যুৎ বা চার্জ প্রবাহিত করা হলে, যে পরিমাণ পদার্থ ক্যাথোডে সঞ্চিত হয় বা অ্যানোড থেকে দ্রবীভূত হয়, সে পরিমাণকে তড়িৎ রাসায়নিক তুল্যাঙ্ক বলা হয়।
উল্লেখ্য যে তড়িৎ রাসায়নিক তুল্যাঙ্ক Z=nFM
বা, Z=n×96500CM
[ M = গ্রাম পারমানবিক ভর
n = যোজনী বা চার্জ
F = 96500c ]
∴W=nFMIt
এটিই ফ্যারাডের প্রথম সুত্রের গাণিতিক প্রকাশ
ফ্যারাডের ২য় সূত্র (Faraday’s 2nd Law): যদি বিভিন্ন তড়িৎ বিশ্লেষ্যের মধ্য দিয়ে একই পরিমাণ বিদ্যুৎ একই সময় ধরে চালনা করা হয় তাহলে বিভিন্ন তড়িৎদ্বারে সঞ্চিত পদার্থের পরিমাণ তাদের নিজ নিজ পারমাণবিক ভরকে যোজনী বা চার্জ সংখ্যা দিয়ে ভাগ করলে যে ভাগফল পাওয়া যায়, তার সমানুপাতিক হবে ।
অর্থাৎ রাসায়নিক তুল্যাঙ্কের সমানুপাতিক হবে।
যদি Q পরিমাণ বিদ্যুৎ বা চার্জ প্রবাহের ফলে কোন তড়িৎদ্বারে W গ্রাম ভরের কোন পদার্থ দ্রবীভূত বা সঞ্চিত হয় তাহলে ফ্যারাডের ২য় সূত্র মতে,
WαVM [v = যোজনী, M = পারমাণবিক ভর]
বা, vMw=k (ধ্রুবক)
যদি তিনটি তড়িৎ বিশ্লেষ্যের মধ্য দিয়ে একই পরিমাণ বিদ্যুৎ একই সময় ধরে চালনা করার ফলে এদের মধ্যে যথাক্রমে w1, w2, w3 পরিমাণ পদার্থ সঞ্চিত হয়। তাহলে ফ্যারাডের ২য় সূত্র মতে,
v1M1w1=v2M2w2=v3M3w3=k
Note: রাসায়নিক তুল্যাঙ্ক E=nM কোনো তড়িৎ বিশ্লেষ্যের মধ্যে 1F চার্জ প্রবাহিত করলে অ্যানোডে দ্রবীভূত বা ক্যাথোডে সঞ্চিত পদার্থের পরিমাণকে ঐ মৌলের রাসায়নিক তুল্যাঙ্ক বলে। তড়িৎ রাসায়নিক তুল্যাঙ্ক,
Z=nFM বা, n×96500CM (কোনো তড়িৎ বিশ্লেষ্যের মধ্যে 1C বিদ্যুৎ চার্জ প্রবাহিত করলে অ্যানোডে দ্রবীভূত বা ক্যাথোডে সঞ্চিত পদার্থকে ঐ মৌলের তড়িৎ রাসায়নিক তুল্যাঙ্ক বলে।
তড়িৎ রাসায়নিক তুল্যাঙ্ক ও রাসায়নিক তুল্যাঙ্কের মধ্যে সম্পর্ক হল Z=FE
প্রশ্ন : Ag এর তড়িৎ রাসায়নিক তুল্যাঙ্ক 0.00118gmc-1 বলতে কী বুঝ? (What is 0.00118gmc-1 electrochemical equivalent of Ag?)
উত্তরঃ
Ag এর তড়িৎ রাসায়নিক তুল্যাঙ্ক 0.00118gmc−1 এর অর্থ হল AgNO3 এর দ্রবণে তড়িৎ বিশ্লেষণের সময় এক কুলম্ব বিদ্যুৎ প্রবাহের ফলে কোন তড়িৎদ্বারে 0.00118gmc−1 সিলভার সঞ্চিত বা দ্রবীভূত হয়।
প্রশ্ন : তড়িৎ রাসায়নিক তুল্যাঙ্ক কী? (What is electrochemical equivalent?)
উত্তরঃ
তড়িৎ বিশ্লেষ্যের মধ্য দিয়ে এক কুলম্ব বিদ্যুৎ প্রবাহের ফলে কোন পদার্থের যত পরিমাণ অ্যানোডে দ্রবীভূত হয় বা ক্যাথোডে সঞ্চিত হয় তাকে সে পদার্থের তড়িৎ রাসায়নিক তুল্যাঙ্ক বলে।
প্রশ্ন : ফ্যারাডের ধ্রুবক কী?(What is Faraday’s constant?)
উত্তরঃ
প্রতি মোল e− এর চার্জকে ফ্যারাডে ধ্রুবক বলা হয়। অর্থাৎ ফ্যারাডে ধ্রুবক =96500cmol−1
প্রশ্ন : ফ্যারাডের তড়িৎ বিশ্লেষণের সূত্র হতে 1টি e− এর চার্জ নির্ণয় কর। (Find the charge of 1e− from Faraday’s law of electrolysis.)
উত্তরঃ
ফ্যারাডের প্রথম সূত্র মতে, এক মোল ইলেকট্রনের চার্জ সমান এক ফ্যারাডে।
অর্থাৎ, NAe−1=1F=96500C
এখানে, NA= অ্যাভোগেড্রো সংখ্যা,
e− = একটি ইলেকট্রনের চার্জ
∴e−=NA96500C=6.022×102396500C=1.602×10−19C
প্রশ্নঃ তড়িৎ প্রলেপন বা Electroplating কী?(What is electroplating?)
উত্তরঃ
তড়িৎ বিশ্লেষণের মাধ্যমে একটি ধাতুর তৈরি জিনিসপত্রের উপর অন্য একটি কম সক্রিয় ধাতুর প্রলেপ সৃষ্টি করাকে ইলেকট্রোপ্লেটিং বলে। সাধারণত উজ্জ্বলতা সৃষ্টি বা ক্ষয় রোধ করার জন্য এটি করা হয়।
প্রশ্ন : তড়িৎ দক্ষতা বলতে কী বুঝ?(What is electro efficiency?)
উত্তরঃ
কোন তড়িৎ বিশ্লেষণ প্রক্রিয়ায় ক্যাথোডে যে পরিমাণ পদার্থ সঞ্চিত হয় এবং যে পরিমাণ পদার্থ বা মৌল সঞ্চিত হওয়ার কথা, এ দুয়ের অনুপাতকে তড়িৎ দক্ষতা বলে। যেমন 1F তড়িৎ প্রবাহিত করলে নিকেল লবণের দ্রবণ থেকে ক্যাথোডে কাঙ্ক্ষিত 29.34g নিকেল জমা হওয়ায় পরিবর্তে 25.48 গ্রাম জমা হয়। বাকি 3.86g নিকেলের সমতুল্য 0.1326 গ্রাম H2 গ্যাস উৎপন্ন হয়।
∴ এ দ্রবণের তড়িৎ দক্ষতা= 29.3425.48=0.8648=86.48%
ফ্যারাডের সূত্রের প্রযোজ্যতা
ফ্যারাডের সূত্র, যা ফ্যারাডের ইলেকট্রোলাইটিক আইন (Faraday's Law of Electrolysis) নামেও পরিচিত, ইলেকট্রোলাইসিস প্রক্রিয়ায় ইলেকট্রনের গতিবিধি এবং প্রভাব বিশ্লেষণে ব্যবহৃত হয়। এটি মূলত দুটি সূত্রে বিভক্ত:
- প্রথম সূত্র: ইলেকট্রোলাইসিসের মাধ্যমে একটি নির্দিষ্ট পরিমাণ পদার্থের ক্ষয় বা জমা হওয়া ইলেকট্রিক কারেন্টের পরিমাণের সাথে সোজা অনুপাতিক। এর মানে হলো, যদি কারেন্টের পরিমাণ বাড়ানো হয়, তবে পদার্থের ক্ষয় বা জমা হওয়া পরিমাণও বাড়বে।
- দ্বিতীয় সূত্র: ইলেকট্রোলাইসিসের মাধ্যমে সৃষ্ট পদার্থের পরিমাণ নির্ভর করে ইলেকট্রিক চার্জের পরিমাণের উপর। অর্থাৎ, ইলেকট্রনের পরিমাণ বা মোট চার্জের সাথে সম্পর্কিত।
ফ্যারাডের সূত্র বিভিন্ন বৈজ্ঞানিক এবং শিল্প ক্ষেত্রেও ব্যবহৃত হয়, যেমন:
- ধাতু পরিশোধন: যেমন সোনা বা তামার পরিশোধন।
- ব্যাটারি চার্জিং এবং ডিসচার্জিং: বৈদ্যুতিন যন্ত্রে ব্যাটারি ব্যবহারের ক্ষেত্রে।
- ইলেকট্রোলাইটিক পরিশোধন: যেমন তামা, সোনা, আর্দ্রতা পরিশোধন ইত্যাদি।
ফ্যারাডের সূত্রের মাধ্যমে ইলেকট্রোলাইসিস প্রক্রিয়া সুস্পষ্টভাবে বর্ণনা করা সম্ভব এবং এটি বৈদ্যুতিন রসায়ন এবং পদার্থবিদ্যার জন্য অত্যন্ত গুরুত্বপূর্ণ।
ফ্যারাডের সূত্রের সীমাবদ্ধতা
যদিও ফ্যারাডের সূত্র ব্যাপকভাবে ব্যবহার করা হয়, তবে এর কিছু সীমাবদ্ধতাও রয়েছে, যেমন:
- সিদ্ধান্তের নির্ভরতা শর্তাধীন: ফ্যারাডের সূত্র তখনই প্রযোজ্য যখন ইলেকট্রোলাইসিস প্রক্রিয়া সরাসরি বিশুদ্ধ বা নির্দিষ্ট ইলেকট্রোলাইটের মাধ্যমে ঘটে। কিছু অজানা বা জটিল পদার্থের জন্য এটি নির্ভুল হতে পারে না।
- শক্তির ক্ষতি: বাস্তবে, ইলেকট্রোলাইটিক প্রতিক্রিয়া সম্পূর্ণভাবে কার্যকর হয় না, অর্থাৎ কিছু শক্তি খরচ হয় যা সঠিক পরিমাণে হিসাব করা কঠিন। এতে কিছু শক্তি ক্ষতি হয়, যা ফ্যারাডের সূত্রে সঠিকভাবে প্রতিফলিত হয় না।
- তাপমাত্রার প্রভাব: তাপমাত্রা পরিবর্তন হলে ইলেকট্রোলাইটিক প্রতিক্রিয়ায় কিছু অস্থিরতা আসতে পারে, যার ফলে সূত্রের প্রযোজ্যতা কমে যেতে পারে।
- অপটিমাল শর্তের অভাব: প্রতিটি রসায়নীয় প্রক্রিয়া একে অপরের থেকে ভিন্ন হতে পারে এবং প্রক্রিয়াটি বেশ কিছু শর্তের উপর নির্ভরশীল হতে পারে, যেমন তাপমাত্রা, চাপ, কনসেনট্রেশন ইত্যাদি।
সারাংশ
ফ্যারাডের সূত্র ইলেকট্রোলাইটিক প্রতিক্রিয়ায় পদার্থের ক্ষয় বা জমা হওয়া ইলেকট্রিক কারেন্টের পরিমাণের সাথে সম্পর্কিত। এটি শিল্প এবং বৈজ্ঞানিক ক্ষেত্রে ব্যাপকভাবে ব্যবহৃত হলেও কিছু সীমাবদ্ধতা যেমন তাপমাত্রার প্রভাব, শক্তির ক্ষতি এবং শর্তাধীন ব্যবহার রয়েছে, যা এই সূত্রের প্রযোজ্যতার পরিসীমা সীমাবদ্ধ করে।
ফ্যারাডের সূত্র প্রয়োগে তড়িৎ বিশ্লেষ্যে পদার্থের পরিমাণ নির্ণয়
ফ্যারাডের সূত্র তড়িৎ বিশ্লেষণে পদার্থের পরিমাণ নির্ণয়ের একটি গুরুত্বপূর্ণ উপায়। এটি মূলত বৈদ্যুতিন প্রতিক্রিয়াগুলির মাধ্যমে কোনো পদার্থের পরিমাণ গণনা করতে ব্যবহৃত হয়। ফ্যারাডের সূত্র তড়িৎ বিশ্লেষণ এবং ইলেকট্রোলাইসিসের ক্ষেত্রে ব্যাপকভাবে ব্যবহৃত হয়। এটি একটি পদার্থের পরিমাণ নির্ধারণ করার জন্য ইলেকট্রনিক প্রতিক্রিয়া এবং তার সাথে সম্পর্কিত বৈদ্যুতিন পরিমাণের (চার্জ) মধ্যে সম্পর্ক স্থাপন করে।
ফ্যারাডের সূত্র
ফ্যারাডের সূত্র অনুসারে, কোনো পদার্থের পরিমাণ নির্ণয় করতে পারা যায় ইলেকট্রোলাইটে চলমান চার্জের পরিমাণের সাহায্যে। ফ্যারাডের সূত্রের রূপ হলো:
\[
m = \dfrac{M \times I \times t}{n \times F}
\]
যেখানে:
- \(m\) = পদার্থের পরিমাণ (গ্রামে)
- \(M\) = পদার্থের আণবিক ভর (গ্রামে প্রতি মোল)
- \(I\) = বৈদ্যুতিন প্রবাহ (অ্যাম্পিয়ার)
- \(t\) = সময় (সেকেন্ড)
- \(n\) = প্রতিটি আণুর জন্য ইলেকট্রনের সংখ্যা
- \(F\) = ফ্যারাডে ধ্রুবক (৯৬,৪৮৫ কুলম্ব প্রতি মোল)
ফ্যারাডের সূত্রের প্রয়োগ
ফ্যারাডের সূত্রটি মূলত তড়িৎ বিশ্লেষণের মাধ্যমে কোনো পদার্থের মোল পরিমাণ, পরিমাণ এবং ইলেকট্রিক্যাল চার্জের সম্পর্ক নির্ধারণ করতে ব্যবহৃত হয়। এটি বিভিন্ন ধরনের ইলেকট্রোলাইটিক প্রক্রিয়া, যেমন ধাতু প্রাপ্তি, রূপান্তর, ইলেকট্রোলাইসিস ইত্যাদিতে ব্যবহার করা হয়।
উদাহরণস্বরূপ, ধরা যাক একটি ইলেকট্রোলাইটিক সেল ব্যবহার করে ১০ গ্রাম সোনা (Au) উত্তোলন করতে চাইলে, ফ্যারাডের সূত্র ব্যবহার করে নির্ধারণ করা যাবে কত সময় ধরে কত অ্যাম্পিয়ার প্রবাহ প্রয়োগ করতে হবে।
প্রয়োগের ধাপ
১. প্রথমে তথ্য সংগ্রহ করা: প্রতিটি পদার্থের জন্য আণবিক ভর, চার্জ, প্রবাহ ইত্যাদি তথ্য সংগ্রহ করতে হবে।
২. ফ্যারাডের সূত্রে উপাত্ত স্থাপন করা: সূত্রে উপাত্ত সন্নিবেশ করে, গণনা করা হবে পদার্থের পরিমাণ।
৩. পরীক্ষা ও সমন্বয়: ফলাফল যাচাই করা এবং প্রয়োজনে সমন্বয় করা।
সারাংশ
ফ্যারাডের সূত্রের মাধ্যমে তড়িৎ বিশ্লেষণে পদার্থের পরিমাণ নির্ধারণ একটি গুরুত্বপূর্ণ কৌশল। এটি বিভিন্ন বৈদ্যুতিন প্রতিক্রিয়া এবং তড়িৎ বিশ্লেষণ প্রক্রিয়ার ক্ষেত্রে ব্যবহৃত হয়, যেখানে চার্জ, সময়, প্রবাহ এবং পদার্থের আণবিক ভরের সাহায্যে পরিমাণ নির্ধারণ করা সম্ভব হয়।
ফ্যারাডের সূত্র (Faraday's Law) বৈদ্যুতিক চুম্বকীয় ক্ষেত্রের সঙ্গে সম্পর্কিত একটি গুরুত্বপূর্ণ সূত্র যা চুম্বকীয় প্রবাহের পরিবর্তন দ্বারা উৎপন্ন বৈদ্যুতিক ক্ষেত্রের বর্ণনা দেয়। এই সূত্রটির মাধ্যমে চুম্বকীয় ক্ষেত্রের পরিবর্তনকে বৈদ্যুতিক প্রবর্তনের কারণ হিসেবে চিহ্নিত করা হয়।
ফ্যারাডের সূত্র দুটি মূল অংশে বিভক্ত:
ফ্যারাডের প্রথম সূত্র: এটি বলে যে, একটি পরিবাহী চক্রের মধ্য দিয়ে চুম্বকীয় প্রবাহের পরিবর্তনের ফলে ইএমএফ (Electromotive Force) সৃষ্টি হয়। এই সূত্রটি একটি সার্বজনীন গাণিতিক রূপে প্রকাশ করা যায়:
\[
\mathcal{E} = - \frac{d\Phi_B}{dt}
\]এখানে, \(\mathcal{E}\) হলো ইএমএফ, \(\Phi_B\) হলো চুম্বকীয় প্রবাহ এবং \(t\) হলো সময়।
- ফ্যারাডের দ্বিতীয় সূত্র: এটি চুম্বকীয় প্রবাহের পরিবর্তনের সাথে সম্পর্কিত বলকে বিদ্যুৎ প্রবাহে রূপান্তরিত হওয়ার উপায়ে আলোচনা করে। এর মানে, যদি চুম্বকীয় প্রবাহ পরিবর্তিত হয়, তবে একটি বৈদ্যুতিক ক্ষেত্র সৃষ্টি হবে যা প্রবাহের উৎপত্তি ঘটাবে।
ফ্যারাডের সূত্রের তাৎপর্য:
- চুম্বকীয় এবং বৈদ্যুতিক ক্ষেত্রের সম্পর্ক: ফ্যারাডের সূত্র চুম্বকীয় এবং বৈদ্যুতিক ক্ষেত্রের মধ্যে একটি মৌলিক সম্পর্ক স্থাপন করে। এটি বৈদ্যুতিক প্রবাহ এবং চুম্বকীয় প্রবাহের পরিবর্তন কীভাবে একে অপরকে প্রভাবিত করে তা বুঝতে সাহায্য করে।
- বিদ্যুৎ উৎপাদন: ফ্যারাডের সূত্রের মাধ্যমে বিদ্যুৎ উৎপাদনের প্রক্রিয়াকে ব্যাখ্যা করা হয়। এটি জানায় যে চুম্বকীয় প্রবাহের পরিবর্তন থেকে বৈদ্যুতিক শক্তি উৎপন্ন হতে পারে, যেমন বিদ্যুৎ জেনারেটর ও ট্রান্সফর্মারগুলির মাধ্যমে বিদ্যুৎ উৎপাদন।
- ইলেকট্রোম্যাগনেটিক ইনডাকশন: এটি ইলেকট্রোম্যাগনেটিক ইনডাকশন বা বৈদ্যুতিক চুম্বকীয় প্রবর্তনের ভিত্তি হিসেবে কাজ করে, যা বৈদ্যুতিক শক্তি উৎপাদনের একটি মৌলিক পদ্ধতি।
এভাবে, ফ্যারাডের সূত্র বৈদ্যুতিক প্রকৌশল ও চুম্বকীয় তত্ত্বের ক্ষেত্রে একটি মৌলিক ও অপরিহার্য উপাদান হিসেবে কাজ করে।
# বহুনির্বাচনী প্রশ্ন
আপনি "দ্রবণে আয়ণিক যৌগের তড়িৎ বিশ্লেষণ, ইলেকট্রোড বিক্রিয়া" বিষয়টি নিয়ে একটি টিউটোরিয়াল লিখতে চান, ভূমিকা ও উপসংহার বাদে। এর জন্য আমি কিছু গুরুত্বপূর্ণ বিষয়কে প্রধান্য দিতে পারি, যা আপনাকে এই টিউটোরিয়াল লিখতে সহায়ক হবে।
দ্রবণে আয়ণিক যৌগের তড়িৎ বিশ্লেষণ
আয়ণিক যৌগের বৈশিষ্ট্য:
দ্রবণে আয়ণিক যৌগের গঠন ও বৈশিষ্ট্যগুলির তড়িৎ বিশ্লেষণ করা হলে, আমাদের প্রথমে আয়নগুলির আচরণ ও তাদের পরিবাহিতা সম্পর্কে জানতে হবে। আয়ণিক যৌগের দ্রবণে তড়িৎ পরিবাহিতা আয়নগুলির বৈদ্যুতিক গুণাবলী নির্ধারণে সাহায্য করে। দ্রবণটির পরিবাহিতা নির্ভর করে আয়নগুলির ঘনত্ব এবং গতির উপর।
তড়িৎ পরিবাহিতা:
দ্রবণে আয়ণিক যৌগের তড়িৎ পরিবাহিতা গুণতঃ সন্নিবেশিত আয়ন এবং তাদের গতি দ্বারা নির্ধারিত হয়। একটি আয়নিত দ্রবণে আয়নগুলির মুভমেন্ট একটি বিদ্যুৎ ক্ষেত্রের প্রভাবেই পরিচালিত হয়। উদাহরণস্বরূপ, সোডিয়াম ক্লোরাইডের দ্রবণে সোডিয়াম এবং ক্লোরাইড আয়নরা পৃথক হয়ে চলতে পারে এবং তাদের আধান পরিবহন করে।
ইলেকট্রোড বিক্রিয়া
ইলেকট্রোড বিক্রিয়া এবং তার উদাহরণ:
ইলেকট্রোড বিক্রিয়া হল একটি রাসায়নিক বিক্রিয়া যা দুটি ইলেকট্রোডের মধ্যে ঘটে যখন একটি বৈদ্যুতিক কারেন্ট তাদের মাধ্যমে প্রবাহিত হয়। এই প্রক্রিয়াটি সাধারণত সেল রিঅ্যাকশন বা গ্যালভানিক সেলের মাধ্যমে দেখা যায়, যেখানে বৈদ্যুতিক শক্তি রাসায়নিক শক্তিতে রূপান্তরিত হয়।
ইলেকট্রোডের তড়িৎ বিশ্লেষণ:
একটি ইলেকট্রোড বিক্রিয়ার বিশ্লেষণে, ভোল্টেজ এবং কারেন্টের পরিবর্তনসহ বিভিন্ন গতিবিধি দেখা যায়। কেবলমাত্র তড়িৎ আধান পরিবহন নয়, বরং তাতে প্রাপ্ত গ্যাস বা পদার্থের পরিমাণও গুরুত্বপূর্ণ। উদাহরণস্বরূপ, জলীয় দ্রবণে পানির বৈদ্যুতলনি বিশ্লেষণে ইলেকট্রোডের মাধ্যমে হাইড্রোজেন এবং অক্সিজেন গ্যাসের উৎপত্তি হয়।
সারাংশ
এই টিউটোরিয়ালে আমরা দ্রবণে আয়ণিক যৌগের তড়িৎ বিশ্লেষণ এবং ইলেকট্রোড বিক্রিয়ার মূল ধারণা ও কার্যপদ্ধতি সম্পর্কে আলোচনা করেছি। আয়ণিক যৌগের দ্রবণে আয়নগুলির গতি ও বৈদ্যুতিক আচরণ বিশ্লেষণ করা এবং তাতে ইলেকট্রোডের ভূমিকা ও বিক্রিয়া বোঝা গুরুত্বপূর্ণ।
তড়িৎ বিশ্লেষণনের ব্যবহার শিল্পক্ষেত্রে
তড়িৎ বিশ্লেষণনের (Electroanalysis) বিভিন্ন পদ্ধতি শিল্পক্ষেত্রে গুরুত্বপূর্ণ ভূমিকা পালন করে থাকে। এই প্রযুক্তির মাধ্যমে রাসায়নিক পদার্থের গুণাগুণ নির্ণয়, উপাদান বিশ্লেষণ, এবং মান নিয়ন্ত্রণ করা হয়। শিল্পক্ষেত্রে তড়িৎ বিশ্লেষণের কিছু উল্লেখযোগ্য ব্যবহার নিম্নে আলোচনা করা হলো।
শিল্পক্ষেত্রে তড়িৎ বিশ্লেষণনের ব্যবহারসমূহ
১. খাদ্য শিল্পে ব্যবহৃত উপাদানের বিশ্লেষণ:
খাদ্য শিল্পে বিভিন্ন উপাদানের বিশুদ্ধতা ও গুণাগুণ নিশ্চিত করতে তড়িৎ বিশ্লেষণের পদ্ধতি ব্যবহার করা হয়। বিশেষত খাদ্যে ভেজাল এবং উপাদানের উপস্থিতি নির্ধারণে এটি কার্যকর।
২. পরিবেশগত বিশ্লেষণ:
তড়িৎ বিশ্লেষণনের মাধ্যমে পানি, মাটি এবং বাতাসে বিভিন্ন রাসায়নিক উপাদানের পরিমাণ নির্ধারণ করা হয়। শিল্প কারখানা থেকে নির্গত দূষক গ্যাস ও বর্জ্যের মান নিয়ন্ত্রণে এটি বিশেষভাবে কার্যকর।
৩. ঔষধ ও রসায়ন শিল্পে বিশুদ্ধতা নির্ণয়:
ঔষধ এবং রসায়ন শিল্পে কাঁচামাল ও উৎপাদিত পণ্য পরীক্ষা করে দেখার জন্য তড়িৎ বিশ্লেষণের বিভিন্ন পদ্ধতি ব্যবহার করা হয়। এর মাধ্যমে ঔষধের গুণাগুণ এবং কার্যকারিতা নির্ণয় করা হয়।
৪. ধাতু ও খনিজ পদার্থের বিশ্লেষণ:
তড়িৎ বিশ্লেষণ ব্যবহার করে ধাতু ও খনিজ পদার্থের বিশুদ্ধতা নির্ধারণ করা হয়। বিশেষত খনি থেকে উত্তোলিত ধাতু এবং অন্যান্য উপকরণের মান নিশ্চিত করতে এটি ব্যবহার করা হয়।
৫. ব্যাটারি ও শক্তি সংরক্ষণ প্রযুক্তি:
ব্যাটারি এবং শক্তি সংরক্ষণ প্রযুক্তির ক্ষেত্রে তড়িৎ বিশ্লেষণের পদ্ধতি ব্যবহার করে ব্যাটারির কার্যকারিতা এবং আয়ু নির্ধারণ করা হয়।
৬. জ্বালানি শিল্পে গ্যাস বিশ্লেষণ:
জ্বালানি শিল্পে বিভিন্ন গ্যাস যেমন, হাইড্রোজেন, অক্সিজেন, নাইট্রোজেন প্রভৃতি বিশ্লেষণ করতে তড়িৎ বিশ্লেষণের পদ্ধতি কার্যকর। এটি জ্বালানির গুণগত মান নির্ধারণে সহায়তা করে।
প্রশ্ন : ধাতুর সক্রিয়তা সিরিজ কী?(What is reactivity series of metals?)
উত্তর :
সংজ্ঞা : একক প্রতিস্থাপন বিক্রিয়ার মাধ্যমে ধাতুসমূহের সক্রিয়তার তুলনামূলক যে সারি রসায়নবিদেরা তৈরি করেছেন ধাতুসমূহের এ সারিকে ধাতুর সক্রিয়তা সিরিজ বলা হয়। এ সারিতে সবচেয়ে অধিক সক্রিয় ধাতুটিকে ওপরে এবং সবচেয়ে কম সক্রিয় ধাতুতে সারির নিচে দেয়া হয়েছে।
ধাতুর সক্রিয়তা সিরিজ : (Reactivity series of Metals)
সংজ্ঞা (Definiton):
ধাতব মৌলসমূহকে তাদের ইলেকট্রন ত্যাগের প্রবণতার তথা সক্রিয়তার নিম্নক্রম অনুসারে সাজিয়ে প্রাপ্ত সিরিজকে ধাতুর সক্রিয়তা সিরিজ বলা হয়।
বৈশিষ্ট্য (Characteristics):
ধাতুর সক্রিয়তা সিরিজের কতিপয় উল্লেখযোগ্য বৈশিষ্ট্য রয়েছে যা নিম্নরূপ:
(i) এই সিরিজে যে ধাতব মৌলের অবস্থান যত উপরে সেই মৌলটি তত বেশি সক্রিয়।
(ii) এই সিরিজে উপস্থাপিত যে কোনো মৌল তার নিচে অবস্থিত যে কোনো মৌলকে তার যৌগ থেকে (যখন দ্রবীভূত অবস্থায় থাকে) প্রতিস্থাপন করতে পারে।
প্রশ্ন: তড়িৎ বিশ্লেষ্যের পরিবাহিতা কোন কোন বিষয়ের উপর নির্ভর করে?(What are the factors conductance of electrolytes depend on?)
কোনো নির্দিষ্ট তাপমাত্রায় নির্দিষ্ট ঘনমাত্রার তড়িৎ বিশ্লেষ্যের পরিবাহিতা সবসময় নির্দিষ্ট থাকে। কিন্তু তড়িৎ বিশ্লেষ্যের ঘনমাত্রা পরিবর্তন করলে পরিবাহিতার মানের পরিবর্তন ঘটে। এক্ষেত্রে দুই ধরনের পরিবাহিতা নিয়ে ব্যাখ্যা করা হলো।
(ক) আপেক্ষিক পরিবাহিতা (Specific Conductance): কোনো দ্রবণের প্রতি cm3 এর পরিবাহিতাকে এর আপেক্ষিক পরিবাহিতা বলে। সুতরাং প্রতি সিসি আয়তনে আয়ন সংখ্যার উপর দ্রবণের আপেক্ষিক পরিবাহিতা নির্ভর করে। আধুনিক তত্ত্ব অনুসারে তীব্র তড়িৎ বিশ্লেষ্য পদার্থগুলো দ্রবণে সম্পূর্ণরূপে আয়নিত অবস্থায় থাকে। এ দ্রবণকে লঘু করলে দ্রাবকের প্রভাবে আন্ত:আনবিক আকর্ষণ হ্রাসের দরুন দ্রবণে কার্যকরী আয়নের মোট সংখ্যা কিছুটা বৃদ্ধি পায় বটে। কিন্তু প্রতি সিসিতে যে পরিমাণ আয়ন বাড়ে লঘুকরণের কারণে প্রতি সিসিতে তা অপেক্ষা অধিক হ্রাস পায়। তাই দ্রবণ লঘুকরণের সাথে সাথে তীব্র তড়িৎ বিশ্লেষ্য পদার্থগুলোর আপেক্ষিক পরিবাহিতা হ্রাস পেতে থাকে। মৃদু তড়িৎ বিশ্লেষ্য পদার্থগুলো সাধারণ ঘনমাত্রার দ্রবণে আংশিকভাবে বিয়োজিত হয়। এরূপ দ্রবণকে লঘু করলে বিয়োজনমাত্রা সামান্য পরিমাণে বাড়ে সত্য কিন্তু এতে প্রতি সিসিতে যে পরিমাণ আয়ন সংখ্যা বাড়ে লঘুকরণের দরুন প্রতি সিসিতে আয়ন সংখ্যা তা অপেক্ষা অধিক হ্রাস পায়। এ কারণে মৃদু তড়িৎ বিশ্লেষ্যের ক্ষেত্রেও লঘুকরণের ফলে আপেক্ষিক পরিবাহিতা হ্রাস পায়। অর্থাৎ তীব্র বা মৃদু যে কোন প্রকার তড়িৎ বিশ্লেষ্যের ক্ষেত্রে দ্রবণকে লঘু করলে আপেক্ষিক পরিবাহিতা হ্রাস পায়।
(খ) তুল্য পরিবাহিতা (Equivalent Conductance): দ্রবণের ১ গ্রাম তুল্য ওজন তড়িৎ বিশ্লেষ্য হতে উৎপন্ন মোট আয়নের পরিবাহিতাই হল দ্রবণটির তুল্য পরিবাহিতা। তীব্র তড়িৎ বিশ্লেষ্য পদার্থগুলো সব ঘনমাত্রাতেই সম্পূর্ণরূপে আয়নিত হতে পারে। এ দ্রবণকে আরও লঘু করলে ১ গ্রাম তুল্য ওজন তড়িৎ বিশ্লেষ্য হতে আর অধিক আয়ন পাওয়া যায় না। সুতরাং এ ধরনের দ্রবণ লঘু করলে তুল্য পরিবাহিতার কোনো পরিবর্তন হবে না। কিন্তু আয়নগুলোর মধ্যে পারস্পরিক আকর্ষণ থাকার কারণে গাঢ় দ্রবণে প্রতিটি আয়ন এর চারপাশের বিপরীত আয়নের সাথে আয়ন আবহমন্ডল (ionic atmosphere) সৃষ্টি করে পুঞ্জীভূত হয়ে থাকে। ফলে দ্রবণে ১ গ্রাম তুল্য ওজন পরিমাণ তড়িৎ বিশ্লেষ্য হতে প্রাপ্ত সব আয়ন পরিবাহিতায় অংশগ্রহণ করতে পারে না। কিন্তু দ্রবণ লঘু করলে দ্রাবকের প্রভাবে আয়ন আবহমন্ডল ভেঙ্গে গিয়ে আয়নগুলো বিচ্ছিন্ন হয়ে পড়ে। ফলে ১ গ্রাম তুল্য ওজনের তড়িৎ বিশ্লেষ্য হতে উৎপন্ন কার্যকরী আয়ন সংখ্যা দ্রবণ লঘুকরণের সাথে বাড়তে থাকে। আন্ত আয়নিক আকর্ষণ হ্রাস পায় ফলে তড়িৎ পরিবাহিতা বাড়ে। মৃদু তড়িৎ বিশ্লেষ্য পদার্থগুলো দ্রবণে আংশিক বিয়োজিত হয়। দ্রবণ লঘুকরণের সাথে মোট আয়ন সংখ্যাও বাড়ে। ফলে তুল্য পরিবাহিতা বাড়ে।
# বহুনির্বাচনী প্রশ্ন
তড়িৎ রাসায়নিক কোষ ও নার্নস্ট সমীকরণ (Electrochemical Cells and Nernst’s Equation)
প্রশ্ন: তড়িৎ রাসায়নিক কোষ কী?(What is electrochemical cell?)
উত্তর:
যে তড়িৎ কোষে রাসায়নিক বিক্রিয়ার ফলে বিদ্যুৎ প্রবাহ সৃষ্টি হয় অর্থাৎ রাসায়নিক বিক্রিয়ার শক্তি বিদ্যুৎ শক্তিতে রূপান্তরিত হয় তাকে তড়িৎ রাসায়নিক কোষ বলে।
প্রশ্ন: অর্ধকোষ কী এবং অর্ধকোষ বিক্রিয়া বলতে কী বুঝ? (What is half cell and half-cell reaction?)
উত্তর:
কোন তড়িৎ রাসায়নিক কোষে প্রতিটি তড়িৎদ্বার তড়িৎ বিশ্লেষ্যের সংস্পর্শে থাকে। তড়িৎদ্বার এবং তড়িৎবিশ্লেষ্য যুগলকে একসাথে অর্ধকোষ বলা হয় এবং অর্ধকোষের সংঘটিত বিক্রিয়াকে অর্ধকোষ বিক্রিয়া বলে।
যেমন- ডেনিয়েল কোষে অ্যানোড অর্ধকোষ এবং এতে সংঘটিত বিক্রিয়া নিম্নরূপ-
Zn(s)∣ZnSO4(aq)
বা, Zn(s)∣Zn2+(aq) বা, Zn(s)/Zn2+(aq) বা, Zn(s),Zn2+(aq)
অর্ধকোষ বিক্রিয়া (Half-cell reaction) : Zn(s)→Zn2+(aq)+2e−
কোনো অর্ধকোষকে যেভাবে প্রকাশ করলে অ্যানোড হয় ঠিক উল্টোভাবে প্রকাশ করলে ক্যাথোড হবে।
প্রশ্ন : অর্ধকোষের শ্রেণিবিভাগ আলোচনা কর।(Deliberate the classification of half-cell.)
উত্তর:
অর্ধকোষের শ্রেণিবিভাগ নিম্নরূপ-
১। ধাতু এবং ধাতব আয়ন অর্ধকোষ (Metal and metallic ion half-cell):
এরূপ অর্ধকোষ কোনো ধাতুর সংস্পর্শে ঐ ধাতুর আয়নের দ্রবণ থাকে। এ প্রকার অর্ধকোষকে M/M2+(aq) প্রতীক দ্বারা লেখা হয়। ডেনিয়েল কোষের অর্ধকোষ দুটি এ শ্রেণির উদাহরণ:
যেমন- Zn(s)/Zn2+(aq):Cu(s)/Cu2+(aq)
এক্ষেত্রে অর্ধকোষ বিক্রিয়া হল:
M(s)⇋Mn+(aq)+ne− Zn(s)⇋Zn2+(aq)+2e−
Cu(s)⇋Cu2+(aq)+2e−
২। ধাতু এবং এর অদ্রবণীয় লবণের সমন্বয়ে গঠিত অর্ধকোষ(Metal and its insoluble salt half-cell) :
এরূপ অর্ধকোষে কোনো ধাতুকে এর কোনো অদ্রবণীয় লবণের মধ্যে ঢুকিয়ে রেখে ঐ অদ্রবণীয় লবণের অ্যানায়ন সম্বলিত একটি যৌগের দ্রবণ যোগ করা হয়। যেমন, Ag তারকে অদ্রবণীয় AgCl(s) এর মধ্যে ঢুকিয়ে রেখে এতে HCl বা, NaCl দ্রবণ যোগ করে সৃষ্ট অর্ধকোষটি হয়: Ag(s),AgCl(s)/Cl−(aq)
এই শ্রেণির ক্যালোমেল অর্ধকোষটি হল: Hg(l),Hg2Cl2( s)/Cl−(aq)
অ্যানোডরূপে ক্যালোমেল অর্ধকোষ বিক্রিয়া : 2Hg(l)+2Cl−⇋Hg2Cl2( s)+2e−
ক্যাথোডরূপে ক্যালোমেল অর্ধকোষ বিক্রিয়া : Hg2Cl2(s)+2e−⇋2Hg(l)+2Cl−(aq)
৩। ধাতুর অ্যামালগাম এবং ধাতব আয়ন অর্ধকোষ (Metal amalgam and metallic ion half-cell) :
অধিক সক্রিয় ধাতু ও পারদের (Hg) মিশ্রণ দ্বারা তৈরি ধাতু-অ্যামালগাম দণ্ডকে ঐ ধাতুর লবণের দ্রবণে ডুবিয়ে এরূপ অর্ধকোষ তৈরি করা হয়। তবে অ্যামালগাম ব্যবহার করায় ধাতুটির জারণ দ্বারা ধাতব আয়নে রূপান্তর নিয়ন্ত্রিত হয়। যেমন- সোডিয়াম অ্যামালগাম অর্ধকোষ Na.Hg(s)/Na+(aq)
এক্ষেত্রে অর্ধকোষ বিক্রিয়া হল: Na⋅Hg(s)⇋Na+(aq)+e−+Hg(l)
৪। জারণ বিজারণ অর্ধকোষ(Oxidation reduction half-cell):
কোন অবস্থান্তর ধাতুর দুটি ভিন্ন জারণ-সংখ্যা বিশিষ্ট দুটি লবণের দ্রবণে একটি নিষ্ক্রিয় ধাতুর (Pt বা Au) তার বৈদ্যুতিক পরিবাহীরূপে ডুবিয়ে এরূপ অর্ধকোষ তৈরি করা হয়। যেমন,
অর্ধ কোষ :
Pt,Fe2+(aq)/Fe3+(aq)Au,Sn2+(aq)/Sn4+(aq)
জারণ অর্ধকোষ বিক্রিয়া :
Fe2+(aq)⇋Fe3+(aq)+e−Sn2+(aq)⇋Sn4+(aq)+2e−
৫। গ্যাস অর্ধকোষ (Gas half-cell):
এরূপ অর্ধকোষ নিষ্ক্রিয় ধাতুর (Pt) তারকে H2 বা Cl2 গ্যাসের যৌগের দ্রবণে ডুবিয়ে রেখে 25°C ও 1 atm চাপে ঐ গ্যাসটিকে এ দ্রবণে বুদবুদ আকারে চালনা করা হয়। যেমন হাইড্রোজেন অর্ধকোষ।
Pt,H2(g)(1 atm)/H+(aq)(1M)H2(g)⇋2H+(aq)+2e−
প্রশ্ন : গ্যালভানিক কোষ বা ডেনিয়েল সেলের গঠন এবং কার্যপ্রণালী বর্ণনা কর।(Describe the structure and function of Galvanic cell or Deniel cell.)
উত্তর:
একটি কাচ বা চীনামাটির পাত্রের মাঝখানে একটি সরু ছিদ্রযুক্ত দেয়াল দিয়ে একভাগে ZnSO4 এবং অপরভাগে CuSO4 দ্রবণ নেয়া হয়। দ্রবণদ্বয়ের উচ্চতা সমান রাখা হয়। ZnSO4 দ্রবণে Zn এবং CuSO4 দ্রবণে Cu দন্ড নিমজ্জিত করে ও দুটিকে একটি তারের মাধ্যমে যুক্ত করা হয়।
অ্যানোড বিক্রিয়া: Zn(s)⟶Zn2+(aq)+2e−
ক্যাথোড বিক্রিয়া: Cu2+(aq)+2e−⟶Cu(s)
Zn(s)+Cu2+(aq)→Zn2+(aq)+Cu(s)
এ কোষটিকে নিম্নরুপে প্রকাশ করা যায়-
Zn(s)/Zn2+(aq)∣Cu2+(aq)/Cu(s);E0=1.1 V বা, Zn(s)/ZnSO4(aq)∣CuSO4(aq)/Cu(s);E0=1.1 V
প্রশ্ন: তড়িৎ বিশ্লেষ্য ও তড়িৎ রাসায়নিক কোষের মধ্যে পার্থক্য লেখ। অথবা ১ ও ২ নং কোষের পার্থক্য লেখ।(Write the difference between electrolytes and electrochemical cells. Or, Write the difference between 1 & 2.)


১। (i) নং কোষটি একটি তড়িৎ রাসায়নিক কোষ যার মধ্যে রাসায়নিক শক্তি তড়িৎ শক্তিতে রূপান্তরিত হয়।
(ii) নং কোষ একটি তড়িৎ বিশ্লেষ্য কোষ। যাতে বিদ্যুৎশক্তি রাসায়নিক শক্তিতে রূপান্তরিত হয়।
২। (i) নং কোষের বাহ্যিক বর্তনীতে বিদ্যুৎ উৎসের প্রযয়োজন হয় না। কিন্তু,
(ii) নং কোষের বাহ্যিক বর্তনীতে বিদ্যুৎ উৎসের প্রযয়োজন হয়।
৩। (i) নং কোষের অ্যানোড ও ক্যাথোড যথাক্রমে ধণাত্মক ও ঋণাত্মক চার্জযুক্ত।
(ii) নং কোষে তা বিপরীত চিহ্নযুক্ত হয়।
৪। (i) কোষে দুটি ভিন্ন তড়িৎ বিশ্লেষ্যের মধ্যে দুটি ভিন্ন তড়িৎদ্বার ব্যবহৃত হয়। কিন্তু,
(ii) নং কোষে একই তড়িৎ বিশ্লেষ্যের মধ্যে দুটি তড়িৎদ্বার ব্যবহৃত হয়।
৫। (i) নং কোষে জারণ বিজারণ বিক্রিয়া স্বতঃস্ফূর্তভাবে ঘটে। কিন্তু
(ii) নং কোষে উৎসের উপর নির্ভর করে।
৬। (i) নং কোষটি হল শক্তি উৎপাদী কোষ।
(ii) নং কোষ হল শক্তিগ্রাহী কোষ।
৭। (i) নং কোষে রাসায়নিক বিক্রিয়ায় বিমুক্ত ইলেকট্রন প্রবাহের ফলে তড়িৎ প্রবাহ সৃষ্টি হয়।
(ii) নং কোষে দ্রবণে বা গলিত অবস্থায় তড়িৎ বিশ্লেষ্য পদার্থে সৃষ্ট আয়ন দ্বারা তড়িৎ প্রবাহ ঘটে।
৮। (i) নং কোষে ইলেকট্রন প্রবাহের ঠিক বিপরীত দিকে তড়িৎ প্রবাহ ঘটে।
(ii) নং কোষে দ্রবণে বা গলিত তড়িৎ বিশ্লেষ্যর মধ্যে যেদিকে অ্যানায়নের পরিবহন ঘটে সেদিকেই তড়িৎ প্রবাহিত হয়।
৯। (i) নং কোষে অ্যানোডে জারণ ও ক্যাথোডে বিজারণ ঘটে। তবে অ্যানোডের উপাদান নিজে ইলেকট্রন ত্যাগ করে জারিত হয় এবং তড়িৎ বিশ্লেষ্য থেকে ক্যাটায়ন ক্যাথোডে ইলেকট্রন গ্রহণ করে বিজারিত হয় ও জমা পড়ে।
(ii) এ কোষেও অ্যানোডে জারণ ও ক্যাথোডে বিজারণ ঘটে তবে তড়িৎ বিশ্লেষ্য পদার্থ-আয়নীকরণের ফলে সৃষ্ট ঋণাত্মক আয়ন অ্যনোডে আকৃষ্ট হয়ে ইলেকট্রন ত্যাগ করে জারিত হয় এবং ধণাত্মাক আয়ন ক্যাথোডে গিয়ে ইলেকট্রন গ্রহণ করে বিজারিত হয়।

ডেনিয়েল Cell কে পরোক্ষ সংযোগের মাধ্যমে লবণ সেতুর মাধ্যমে তৈরি করা যায়।
Zn(s)∣∣Zn2+(aq)∥Cu2+(aq)∣∣Cu(s)
প্রশ্ন: লবণ সেতু কী? এটি ব্যবহারের সুবিধা কী? (What is salt-bridge? What are the benefits of using it?)
উত্তর:
দুটি অর্ধকোষের মধ্যে পরোক্ষ সংযোগ সাধনের জন্য বিশেষ লবণ যেমন- KCI, KNO3, NH4NO3 এর সম্পৃক্ত দ্রবণ ভর্তি U আকৃতির কাচনলের উভয়মূখকে তুলা দ্বারা বন্ধ করে অর্ধকোষদ্বয়ের উভয় তরলের মধ্যে ডুবিয়ে রাখা হয়। অর্ধকোষদ্বয়ের এরূপ পরোক্ষ সংযোগ সাধনকে লবণ সেতু বা Salt ব্রীজ বলা হয়। লবণ সেতুতে ব্যবহৃত লবণের বৈশিষ্ট্য হল এ লবণের ক্যাটায়ন ও অ্যানায়নের গতিবেগ সমান বা প্রায় হতে হবে। ব্যবহৃত লবণটি কোষ বিক্রিয়ায় অংশগ্রহণ করবে না। লবণ সেতুতে ব্যবহৃত লবণ অর্ধকোষের তড়িৎবিশেষ্যের সাথে কোনো বিক্রিয়া করবে না।
সুবিধা (Benefits):
(i) এটি উভয় তড়িৎ বিশ্লেষ্যের মধ্যে সংযোগ সাধন করে কোষের বর্তনী পূর্ণ করে।
(ii) লবণ সেতুর অভাবে জারণ অর্ধকোষে ধণাত্মক, বিজারণ অর্ধকোষে ঋণাত্মক আয়নের পরিমাণ বেড়ে যায়। ফলে উভয় অর্ধকোষে জারণ বিজারণ বিক্রিয়া বাধাগ্রস্থ হয়। অল্প সময়ের মধ্যে কোষ বিক্রিয়া তথা বিদ্যুৎ প্রবাহ বন্ধ হয়ে যায়। জারণ অর্ধকোষে ধণাত্মক আয়ন বেড়ে গেলে লবণ সেতু থেকে ঋণাত্মক আয়নের ব্যাপন ঘটে। অনুরূপভাবে বিজারন অর্ধকোষে ঋণাত্মক আয়ন বেড়ে গেলে লবণসেতু থেকে ধণাত্মক আয়নের ব্যাপন ঘটে। ফলে উভয় তরলে বৈদ্যুতিক নিরপেক্ষতা বজায় রাখে।
(iii) তড়িৎ বিশ্লেষ্য দুটিকে সছিদ্র দেয়ালের মাধ্যমে পৃথক করা হলে, দেয়ালের গায়ে একটি তরল সংযোগ বিভব সৃষ্টি হয়। ফলে এ কোষ থেকে কিছু পরিমাণ কম বিদ্যুৎ পাওয়া যায়। কিন্তু লবণ সেতু ব্যবহার করা হলে বা লবণ সেতুর মাধ্যমে কোষ তৈরি করা হলে এক্ষেত্রে তরল সংযোগ বিভব তৈরি হয় না বলেই তা থেকে অধিক পরিমাণ বিদ্যুৎ পাওয়া যায়। উল্লেখ্য যে, যখন দুটি তড়িৎ বিশ্লেষ্য দ্রবণ বা একই তড়িৎ বিশ্লেষ্যের দুটি ভিন্ন ঘনমাত্রার দ্রবণ পরস্পর সংস্পর্শে আসে তখন উভয়ের সংযোগস্থলে একটি বিভব পার্থক্য সৃষ্টি হয়। একে তরল সংযোগ বিভব বলে। এ বিভব দ্রুতগামী আয়নের বেগ হ্রাস করে তথা বিক্রিয়ার হার কমে ।
প্রশ্ন: তরল সন্ধি বিভব (Liquid Junction Potential) কি?(What is liquid Junction Potential?)
উত্তর:
ড্যানিয়্যাল কোষে দুটি তড়িৎবিশ্লেষ্যের দ্রবণকে অর্ধভেদ্য পর্দা দ্বারা পৃথকীকৃত অবস্থায় বিদ্যুৎ উৎপন্ন হতে থাকলে দুটি তড়িৎদ্বারের দুই প্রকোষ্ঠের আয়নসমূহ অর্ধভেদ্য পর্দার মধ্য দিয়ে অসম বেগে চলাচল করার কারণে দুই তরলের সংযোগস্থলে যে বিভব সৃষ্টি করে তাকে তরল সন্ধি বিভব (LJP) বলে। যদি ক্যাটায়ন, অ্যানায়ন অপেক্ষা দ্রুতগামী হয় তবে ক্যাটায়নটি অ্যানায়ন অপেক্ষা দ্রুত লঘু দ্রবণে পরিব্যপ্ত হয়। ফলে উক্ত দ্রবণটি ধীরে ধীরে অপেক্ষাকৃত বেশি ঘনমাত্রার দ্রবণের তুলনায় (+)ve চার্জ যুক্ত হয়ে পড়ে।
অপরদিকে অ্যানায়ন, ক্যাটায়ন অপেক্ষা দ্রুতগামী হয় তাহলে অপেক্ষাকৃত লঘু দ্রবনটি ঋণাত্মক চার্জযুক্ত হয়ে পড়ে। তাই দেখা যায় যে উভয় ক্ষেত্রেই উভয় দ্রবণের সংযোগ স্থলে একটি বৈদুতিক দ্বি-স্তর সৃষ্টি হয় এবং বিপরীত চার্জের আকর্ষণের জন্য একটি বিভব (Potential) পার্থক্য সৃষ্টি হয় যা LJP নামে পরিচিতি ।
প্রশ্ন: কীভাবে LJP দূর করে? (How to remove LJP?)
যেহেতু LJP সৃষ্ঠির জন্য অর্ধভেদ্য পর্দার পৃষ্ঠতল বরাবর আয়নসমূহের অসম বেগে চলাচল দায়ী সেহেতু ক্যাটায়ন ও অ্যানায়নের স্বাভাবিক চলাচল নিশ্চিত করে বা ভিন্ন ভিন্ন প্রকোষ্ঠের বিদ্যমান অতিরিক্ত চার্জকে সেখানেই প্রশমিত করার মাধ্যমে LJP হ্রাস করা হয় । লবণ সেতু ব্যবহার করে এ কাজটি করা হয়। যে আয়নসমূহ LJP সৃষ্টি করে লবণ সেতুতে উপস্থিত লবণ উক্ত আয়নসমূহের সাথে বিক্রিয়া করে আয়নসমূহের লবণ গঠন করে ফলে LJP প্রশমতি হয়। যেমন- Zn(s)∣ZnSO4(aq)∣∣CuSO4(aq)∣Cu(s)
LJP সৃষ্টির জন্য Zn2+ ও SO42− আয়ন দায়ী। তখন লবণ সেতুতে ব্যবহৃত লবণ (KCl) উক্ত আয়নদ্বয়ের সাথে বিক্রিয়া করে তাদের লবণ উৎপন্ন করে ফলে LJP প্রশমিত হয়।
Zn2++2Cl−→ZnCl2;SO42−+2 K+→K2SO4
প্রশ্নঃ একক তড়িৎদ্বার বিভব বলতে কী বুঝি?(What is single electrode potential?)
উত্তর:
তড়িৎ রাসায়নিক কোষের প্রত্যেকটি অর্ধকোষে তড়িৎ বিশ্লেষ্য এবং তড়িৎদ্বারের পৃষ্ঠতলে একটি নির্দিষ্ট বৈদ্যুতিক বিভব সৃষ্টি হয় তাকে ঐ তড়িৎদ্বারের একক তড়িৎদ্বার বিভব বলে ।
ব্যাখ্যা (Explanation): কোন তড়িৎদ্বার বা ধাতব দন্ডকে এর লবণের দ্রবণে নিমজ্জিত করলে ধাতব দন্ড হতে ধাতব পরমাণুগুলো আয়নাকারে দ্রবণে আসার প্রবণতা দেখায়। একে ঐ আয়নের দ্রবণ চাপ বলা হয়। আবার, দ্রবণের ধণাত্মক আয়নগুলো e– গ্রহণ করে পুনরায় ধাতব দন্ডে যুক্ত হতে চায়। একে ধাতব আয়নের অসমোটিক চাপ বলা হয়। এ দুটি বিপরীতমূখী প্রক্রিয়া কখনও সমান হয় না, এর ফলে ধাতব দন্ড এবং আয়নের সংস্পর্শ তলে একটি বৈদ্যুতিক বিভব সৃষ্টি হয়। একে তড়িৎদ্বারটির তড়িৎদ্বার বিভব বলে। যদি, দ্রবণ চাপ > অসমোটিক চাপ হয় তাহলে তড়িৎদ্বারটি অ্যানোড হিসেবে কাজ করে এবং অসমোটিক চাপ > দ্রবণ চাপ হলে তড়িৎদ্বারটি ক্যাথোড হিসেবে কাজ করে।
Zn দ্রবণ চাপ⇌অসমোটিক Zn2++2e−
প্রশ্নঃ জারণ বিভব ও বিজারণ বিভব বলতে কী বুঝ?(What is oxidation potential and reduction potential?)
উত্তর:
যে তড়িৎদ্বারে জারণ ঘটে তাকে অ্যানোড এবং অ্যানোডের বিভবকে জারণ বিভব বলে। অ্যানোড হতে দ্রবণে পরমাণুগুলো দ্রবণে আয়ন হিসেবে যাওয়ার প্রবণতার কারণে অ্যানোড ও দ্রবণের সংযোগ স্থলে যে বিভব সৃষ্টি হয়, তাকে জারণ বিভব বলে। যেমন- গ্যালভানিক কোষের অ্যানোড তড়িৎদ্বারের জারণ বিভব হল নিম্নরূপ :
Zn(s)→Zn2+(aq)+2e−;EZn/Zn2+=+0.76 V
যে তড়িৎদ্বারে বিজারণ ঘটে, তাকে ক্যাথোড এবং ক্যাথোডের বিভবকে বিজারণ বিভব বলে। দ্রবণ থেকে ধণাত্মক আয়নের ক্যাথোডে ইলেকট্রন গ্রহণের প্রবণতার কারণে ক্যাথোড এবং দ্রবণের সংযোগস্থলে যে বিভব উৎপন্ন হয়, তাকে বিজারণ বিভব বলে। যেমন: গ্যালভানিক কোষের বিজারণ বিভবের মান :
Cu2+(aq)+2e−→Cu(s);ECu2+/Cu=+0.34 V
উল্লেখ্য যে, কোন তড়িৎদ্বারের জারণ বিভব এবং বিজারণ বিভবের মান সমান কিন্তু বিপরীত চিহ্নযুক্ত হবে। [আয়ন আগে ধাতু পরে হলে বিজারণ বিভব এবং ধাতু আগে আয়ন পরে হলে জারণ বিভব বুঝায়।]
প্রশ্নঃ প্রমাণ তড়িৎদ্বার বিভব বলতে কী বুঝ? (What is standard electrode potential?)
উত্তর:
তড়িৎ রাসায়নিক কোষের কোন অর্ধকোষের তড়িৎদ্বার যে তড়িৎ বিশ্লেষ্য বা আয়নে দ্রবণে নিমজ্জিত থাকে সে দ্রবণের ঘনমাত্রা 1M, তাপমাত্রা 25°C এবং গ্যাসীয় তড়িৎদ্বারের ক্ষেত্রে 1 atm চাপে বুদবুদ আকারে গ্যাস চালনা করা হলে প্রাপ্ত তড়িৎদ্বার বিভবকে প্রমাণ তড়িৎদ্বার বিভব বলে।
প্রশ্নঃ Cu এর প্রমাণ তড়িৎদ্বার বিভব +0.34V বলতে কী বুঝ? (What is +0.34V standard electrode potential of Cu?)
উত্তর:
25°C তাপমাত্রায় 1M ঘনমাত্রার CuSO4 দ্রবণে Cu দন্ড নিমজ্জিত করে প্রাপ্ত অর্ধকোষকে প্রমান H2 তড়িৎদ্বারের সাথে যুক্ত করে যে কোষ পাওয়া যায় তার emf এর মান হচ্ছে +0.34V.
প্রশ্ন : নির্দেশক তড়িৎদ্বার বা Reference তড়িৎদ্বার বলতে কী বুঝ? (What is reference electrode?)
উত্তর:
কোন তড়িৎদ্বারের বিভব মান পরিমাণ করতে হলে, একে অবশ্যই একটি প্রমাণ তড়িৎদ্বারের সাথে যুক্ত করে সম্পূর্ণ কোষ তৈরি করতে হয়। ঐ কোষের EMF মানই পরীক্ষাধীন তড়িৎদ্বারের বিভব মান নির্দেশ করে। এক্ষেত্রে ব্যবহৃত প্রমাণ তড়িৎদ্বারটিকে নির্দেশক বা Reference তড়িৎদ্বার বলে।
যেমন- (i) H2 তড়িদ্বার, (ii) ক্যালোমেল তড়িৎদ্বার ।
উল্লেখ্য যে, প্রমাণ তড়িৎদ্বারের বিভবের মান স্বেচ্ছাকৃতভাবে শূন্য ধরা হয়। নির্দেশক তড়িৎদ্বার দু’প্রকার।
প্রাইমারি বা মুখ্য নির্দেশক তড়িৎদ্বার (Primary Reference electrode) :
প্রমাণ হাইড্রোজেন তড়িৎদ্বারকে (Standard Hydrogen electrode S.H.E) প্রাইমারি বা মুখ্য নির্দেশক তড়িৎদ্বার বলা হয়। কারণ হাইড্রোজেন তড়িৎদ্বার (S.H.E) দ্বারা অন্যান্য তড়িৎদ্বারের প্রমাণ বিভব নির্ণয় করা হয়।

সেকেন্ডারি বা গৌণ নির্দেশক তড়িৎদ্বার (Secondary Reference Electrode):
দৈনন্দিন বিভিন্ন ইলেকট্রোডের বিভব মাপার জন্য প্রাইমারি নির্দেশক তড়িৎদ্বার রূপে প্রমাণ H- তড়িৎদ্বার (S.H.E) ব্যবহার করা সুবিধাজনক নয়। কারণ এর মধ্যে (১)25°C তাপমাত্রায় সব সময় HCl দ্রবণের ঘনমাত্রা 1.0M রাখা যায় না; এবং (২) ঐ HCl দ্রবণে 1atm চাপে বিশুদ্ধ H2গ্যাস চালনা করা সম্ভব হয় না। তাই S.H.E এর পরিবর্তে S.H.E দ্বারা সঠিকভাবে নির্ধারিত তড়িৎ বিভব যুক্ত কিছু ধাতু ও ধাতুর অদ্রবণীয় লবণ তড়িৎদ্বার বা অর্ধকোষকে প্রয়োগ ক্ষেত্রে ব্যবহার করা হয়। এরূপ তড়িৎদ্বার যুক্ত মধ্যকোষকে সেকেন্ডারি বা গৌণ নির্দেশক তড়িৎদ্বার বলে। যেমন-
- i) ক্যালোমেল তড়িৎদ্বার Hg(l),Hg2Cl2(s)∣Cl−(aq)
- ii) সিলভার-সিলভার ক্লোরাইড তড়িৎদ্বার ∣Ag(s),AgCl(s)∣Cl−(aq)
প্রশ্ন: প্রমাণ H2 তড়িৎদ্বার বলতে কী বুঝ? (What is standard H2 electrode?)
উত্তর:
1M ঘনমাত্রার H+ আয়নের দ্রবণে Pt গুড়ার আস্তরণ যুক্ত Pt পাত রেখে এর মধ্যে 25°C তাপমাত্রায় এবং 1 atm চাপে বুদবুদ আকারে বিশুদ্ধ H2 গ্যাস চালনা করা হলে সৃষ্ট তড়িৎদ্বারকে H2 তড়িৎদ্বার প্রকাশ করা হয়।
21H2(g)⇋H++e− এ তড়িৎদ্বারকে নিমরূপে প্রকাশ করা যায়।
Pt,H2( gas )(1 atm)/H+(1M);E0=0V
তড়িৎ কোষে সংযুক্ত অবস্থায় H2 তড়িৎদ্বার অ্যানোড না ক্যাথোড হবে তা নির্ভর করে কোষের অপর তড়িৎদ্বারের বিজারণ বিভবের উপর। যদি অপর তড়িৎদ্বারের বিজারণ বিভবের মান H2 তড়িৎদ্বারের চেয়ে কম হয় তাহলে H2 তড়িৎদ্বার হবে ক্যাথোড এবং এর বিপরীত হলে H2 তড়িৎদ্বার হবে অ্যানোড।
তড়িৎদ্বার অ্যানোড হলে: Pt,H2(1.0 atm)/H+(1.OM);E∘=0.0 Volt
21H2⇋H++e−
তড়িৎদ্বার ক্যাথোড হলে: H+(1.0M)/H2(1.0 atm),Pt
H+(aq)+e−⇋21H2(g)
প্রশ্ন: প্রমাণ হাইড্রোজেন তড়িৎদ্বারের বিভব শূন্য কেন? (Why is the standard hydrogen electrode potential zero?)
উত্তর:
25°C তাপমাত্রায় 1.0atm চাপে বিশুদ্ধ হাইড্রোজেন গ্যাসকে 1.0M HCl এসিডের দ্রবণে অনবরত চালনা করলে প্রমাণ হাইড্রোজেন তড়িৎদ্বার সৃষ্টি হয়। সেহেতু হাইড্রোজেন একটি গ্যাসীয় পদার্থ তাই তড়িৎপ্রবাহের সংযোগের জন্য নিষ্ক্রিয় ধাতু প্লাটিনামের পাত এসিড দ্রবণে রাখা হয়। এ প্লাটিনামের চারপাশ দিয়ে বুদবুদ আকারে হাইড্রোজেন গ্যাস অনবরত চালনা করা হয়।
সুতরাং তড়িৎদ্বারটি হল: Pt,H2(1.0 atm)/H+(1.OM)
এ তড়িৎদ্বারের উপরিতলে নিম্নলিখিত উভমুখী বিক্রিয়া সংঘটিত হয়।
H+(aq)+e⇋21H2(g)
তড়িৎ কোষে ব্যবহৃত কোনো তড়িৎদ্বারের বিভব গণনার সুবিধার্থে মুখ্য নির্দেশক হিসেবে প্রমাণ হাইড্রোজেন তড়িৎদ্বারের সঙ্গে সংযোগ করা হয়। প্রমাণ হাইড্রোজেনের তড়িৎদ্বারের বিভবের মানকে সর্বসম্মতিক্রমে শূন্য ধরা হয়। যেহেতু পূর্ণ তড়িৎকোষের তড়িচ্চালক বল, তড়িৎকোষের ব্যবহৃত দুটি তড়িৎদ্বারের বিভবের সমষ্টির সমান, তাই এক্ষেত্রে তড়িৎকোষের তড়িচ্চালক বলই অজানা তড়িৎদ্বারের বিভবের মান। প্রমাণ হাইড্রেজেনের তড়িৎদ্বারের বিভবের মান শূন্য হলেও তার মানে এই নয় যে, হাইড্রোজেন তড়িৎদ্বারের হাইড্রোজেন ইলেকট্রন ছেড়ে বা গ্রহণের প্রবণতা নেই বা শূন্য। অবশ্যই এ ক্ষেত্রে হাইড্রোজেনের ইলেকট্রন ছেড়ে দেয়া বা গ্রহণ করার প্রবণতা আছে। কিন্তু গণনার সুবিধার্থে বিভবের মান শূন্য ধরে অন্যান্য তড়িৎদ্বারের বিভবের মান নির্ণয় করা হয়।
প্রশ্ন: ক্যালোমেল তড়িৎদ্বার কি?(What is calomel electrode?)
উত্তর:
প্রকৃত পক্ষে হাইড্রোজেন তড়িৎদ্বার ব্যবহার করা খুব একটা সুবিধাজনক নয় বিধায় সেকেন্ডারি নির্দেশক তড়িৎদ্বার উদ্ভাবন করা হয়েছে। হাইড্রোজেন তড়িৎদ্বারের সঙ্গে তুলনা করে এই সেকেন্ডারি নির্দেশক তড়িৎদ্বারের বিভব সঠিকভাবে নির্ণয় করা হয়। যে সমস্ত তড়িৎদ্বার সেকেন্ডারি নির্দেশক হিসেবে ব্যবহৃত হয় তার মধ্যে ক্যালোমেল তড়িৎদ্বার উল্লেখযোগ্য। নিচে একটি ক্যালোমেল তড়িৎদ্বার দেখানো হল:
ক্যালোমেল তড়িৎদ্বারের পাশে একটি সরু নলসহ একটি চওড়া কাচের নলে কিছু পরিমাণ পারদ নিয়ে তার উপর কঠিন মারকিউরাস ক্লোরাইড (Hg2Cl2) লবণ বা ক্যালোমেল নেয়া হয়। এরপর চওড়া কাচের নলটি KCl এর সম্পৃক্ত দ্রবণ দ্বারা পূর্ণ করা হয়। বৈদ্যুতিক সংযোগের জন্য প্লাটিনামের একটি সরু তার তরল পারদের মধ্যে প্রবেশ করানো থাকে। পটাশিয়াম ক্লোরাইডের দ্রবণসহ পাশের নলটি তড়িৎ কোষের লবণ সংযোগকারী হিসেবে কাজ করে। এখানে উল্লেখ্য, দুটি ভিন্ন ঘনমাত্রায়, লবণের দ্রবণ এক হলে সংযোগ স্থানে এক ধরনের বিভবের সৃষ্টি হয় যা তড়িৎদ্বার বিভব সঠিকভাবে গণনার ক্ষেত্রে জটিলতা সৃষ্টি করে। এই জটিলতা দূর করার জন্য লবণ সেতু ব্যবহার করা হয়। ক্যালোমেল তড়িৎদ্বারে নিচের বিক্রিয়াটি সংঘটিত হয়।
ক্যালোমেল ইলেকট্রোড (Calomel Electrode):
Hg,Hg2Cl2( s)/Cl (যখন এটি ক্যাথোড হিসেবে ব্যবহৃত হয়)
Hg2Cl2+2e⇋2Hg(l)+2Cl
প্রশ্ন : কোষের EMF বা তড়িৎচ্চালক বল বলতে কী বুঝ?(What is EMF or electromotive force?)
উত্তর:
কোন তড়িৎ রাসায়নিক কোষের দুটি তড়িৎদ্বারের বিভব পার্থক্যকে ঐ কোষের EMF বলা হয় বা যে বিভব পার্থক্যের কারণে এক তড়িৎদ্বার থেকে অন্য তড়িৎদ্বারে বিদ্যুৎ প্রবাহিত হয় তাকে কোষটির EMF বলে ।
কোন কোষের EMF বা Ecell = অ্যানোডের জারণ বিভব (Eox) + ক্যাথোডের বিজারণ বিভব (Ered)
= অ্যানোডের জারণ বিভব – ক্যাথোডের জারণ বিভব
= ক্যাথোডের বিজারণ বিভব – অ্যানোডের বিজারণ বিভব
প্রশ্ন : কোন তড়িৎ রাসায়নিক কোষে কিভাবে অ্যানোড এবং ক্যাথোড নির্ধারিত হয়? (How are the anode and cathode defined in an electrochemical cell?)
উত্তর:
(i) দুটি তড়িৎদ্বারের মধ্যে যে তড়িৎদ্বার সক্রিয়তা সিরিজের উপরে অবস্থান করে, সেটি হবে অ্যানোডে এবং নিচে অবস্থানকারী অপর তড়িৎদ্বারটি হবে ক্যাথোড।
(ii) দুটি তড়িৎদ্বারের জারণ বিভবের মান দেয়া থাকলে যে তড়িৎদ্বারের জারণ বিভবের মান বেশি হবে, সেটি হবে অ্যানোডে। অপরটি হবে ক্যাথোড। একইভাবে দুটি তড়িৎদ্বারের বিজারণ বিভবের মান দেয়া থাকলে যে তড়িৎদ্বারের বিজারণ বিভবের মান বেশি হবে সেটি হবে ক্যাথোড। অপরটি হবে অ্যানোড।
প্রশ্ন : কোন তড়িৎ রাসায়নিক কোষের স্বতঃস্ফূর্ততা কীরূপে নির্ধারণ করা হয়? (How is the spontaneity of an electrochemical cell defined?)
উত্তর:
কোন কোষের EMF এর মান ধণাত্মক হলে, ঐ কোষের বিক্রিয়া স্বতঃস্ফূর্ত হবে। অর্থাৎ কোষটি বিদ্যুৎ উৎপাদনে সক্ষম হবে। কিন্তু, EMF এর মান ঋণাত্মক হলে কোষ বিক্রিয়া স্বতঃস্ফূর্ত হবে না অর্থাৎ কোষটির বিদ্যুৎ উৎপাদন সম্ভব হবে না।
দেওয়া আছে,
EB/B20=−0.8 VEA/A2∘=+0.44 V
- দুটি তড়িৎদ্বারের সমন্বয়ে একটি কোষ তৈরি কর। কোষ বিক্রিয়া লিখ। ঐ কোষের EMF মান নির্ণয় কর।
- Make a cell combining two electrodes. Write the cell reaction. Define the EMF value of that cell.)
প্রদত্ত জারণ বিভবের মান হতে দেখা যায় যে, B তড়িৎদ্বারটি হবে ক্যাথোড এবং A তড়িৎদ্বারটি হবে অ্যানোড।
কারণ A তড়িৎদ্বারের জারণ বিভবের মান B তড়িৎদ্বার অপেক্ষা বেশি।
দুটি তড়িৎদ্বারের সমন্বয়ে গঠিত কোষ হবে নিম্নরূপ-
A(s)∣∣A2+(aq)∣∣B2+(aq)∣B(s) বা, A(s)∣∣A2+(aq)∣∣∣∣B2+(aq)∣∣B(s)
অ্যানোড: A→A2++2e−
ক্যাথোড: B2++2e−→B
বিক্রিয়া : A+B2+→B+A2+ (মোট বিক্রিয়া)
কোষটির EMF বা Ecell =A তড়িৎদ্বারের জারণ বিভব – B তড়িৎদ্বারের জারণ বিভব
=EA/A2+o−EB2+/Bo=+0.44+0.8=+1.24
যেহেতু EMF এর মান ধণাত্মক তাই কোষ বিক্রিয়া স্বতঃস্ফূর্ত ঘটবে।
- নিমোক্ত কোষের বিক্রিয়াটি স্বত:স্ফূর্তভাবে ঘটবে কি?(Will the following reaction take place independently?)
B∣∣B2+∣∣A2+∣A
কোষটির EMF বা Ecell=B তড়িৎদ্বার জারণ বিভব – A তড়িৎদ্বারের জারণ বিভব
=EB2+/Bo−EA/A2+o=−0.8−0.44=−1.24
EMF negative, তাই স্বত:স্ফূর্ত হবে না।
দেওয়া আছে,
EB/B2∘=+0.76 VEC/C2+0=−0.34 V B+CSO4→BSO4+C
বিক্রিয়াটি স্বতঃস্ফূর্তভাবে হবে কিনা? তা যাচাই কর।
এ বিক্রিয়াটি নিম্নরূপে প্রকাশ করা যায়:
B+C2+→B2++C
এ বিক্রিয়াটি যে কোষে সংঘঠিত হয় তাকে নিম্নরূপে প্রকাশ করা যায়।
B∣∣B2+∣∣C2+∣C
অ্যানোড: B→B2++2e−
ক্যাথোড: C2++2e→C
∴ এ কোষে EMF = EB/B2+−EC/C2+
=0.76+0.34
=1.1V
যেহেতু EMF এর মান ধণাত্মক তাই কোষ বিক্রিয়া স্বতঃস্ফূর্তভাবে সংঘটিত হবে। অর্থাৎ বিক্রিয়াটি স্বত:স্ফূর্তভাবে সংঘটিত হবে।
২য় পদ্ধতি (2nd method): প্রদত্ত জারণ বিভবের মান হতে দেখা যায়, B তড়িৎদ্বারের জারণ বিভবের মান C তড়িৎদ্বার অপেক্ষা বেশি হবে। তাই, C অপেক্ষা B শক্তিশালী বিজারক হবে। এ কারণে B মৌল C2+ আয়নকে বিজারিত করতে পারে। অর্থাৎ বিক্রিয়াটি স্বতঃস্ফূর্ত সংঘটিত হবে।
দেয়া আছে,
EZn2+/Zn0=−0.76 VEPd2+/∘Pd=−0.126 V
উভয় দ্রবণের ঘনমাত্রা একই হলে, Pd ধাতু দ্বারা Zn2+ কে বিজারিত করা যাবে কী? (If the concentration of both solution is same, will Zn2+ be reduced by Pd metal?)
১ম পদ্ধতি (1st method):
যদি Pd ধাতু দ্বারা Zn2+ বিজারিত হয় তাহলে নিম্নোক্ত বিক্রিয়া সংঘটিত হবে।
Pd+Zn2+→Pd2++Zn
এ বিক্রিয়াটি যে কোষে সংঘটিত হয়, তাকে নিম্নরূপে প্রকাশ করা যায়-
Pd∣∣Pd2+∣∣Zn2+∣Zn
এ কোষের EMF বা Ecell =EZn2+/Zn−EPd2+/Pd
=0.76+0.126 = − 0.634V
যেহেতু, কোষের EMF এর মান ঋণাত্মক তাই বিক্রিয়াটি স্বতঃস্ফূর্ত হবে না। অর্থাৎ Pd ধাতু Zn2+ কে বিজারিত করতে পারে না ।
২য় পদ্ধতি (2nd method):
সক্রিয়তা সিরিজে Pd অপেক্ষা Zn উপরের অবস্থান করে। তাই Zn অধিক শক্তিশালী বিজারক এক্ষেত্রে Zn, Pd2+ কে বিজারিত করতে পারলেওPd, Zn2+ কে বিজারিত করতে পারে না।
প্রশ্ন: Zn এর পাত্রে FeSO4 দ্রবণ রাখা যাবে কী?(CanFeSO4 be kept in the container of Zn?) / (Can we keepFeSO4 solution in Zinc container?)
উত্তর :
দেওয়া আছে,
EZn∘Zn2=+0.76 V এবং, EFe/Fe2+∘=+0.44 V
- এ ধরনের সমস্যাবলীতে পাত্রকে অ্যানোড ধরে বিক্রিয়াটি বিবেচনা করতে হবে এবং কোষ গঠন করতে হবে।
- সাধারণত অধিক সক্রিয় ধাতুর পাত্রে কম সক্রিয় ধাতুর দ্রবণ রাখা যাবে না।
Zn এর পাত্রে FeSO4 দ্রবণ রাখা হলে, যদি বিক্রিয়া সংঘটিত হয় তবে একে নিমরূপে প্রকাশ করা যায়-
Zn+FeSO4→ZnSO4+FeZn+Fe2+→Zn2++Fe
এ বিক্রিয়াটি যে কোষে সংঘটিত হয় তা হলে,
Zn∣∣Zn2+∣∣Fe2+∣Fe
এ কোষের EMF বা Ecell=E∘nn/Zn2+−EFe/Fe2+∘
= 0.76 − 0.44 = 0.32
যেহেতু, EMF এর মান ধণাত্মক। তাই কোষ বিক্রিয়া স্বতঃস্ফূর্ত হবে। এ কারণে Zn এর পাত্রে FeSO4 দ্রবণ রাখা যাবে না । অর্থাৎ Zn, Fe2+ কে বিজারিত করতে পারে বলেই বিক্রিয়াটি স্বতঃস্ফূর্ত হবে। কারণ সক্রিয়তা সিরিজে Zn, Fe এর উপরে অবস্থান করে।
প্রশ্ন: তুঁতের দ্রবণে Ag চূর্ণ যোগ করা হলে কোন পরিবর্তন ঘটে না। তবে, AgNO3 দ্রবণে Cu চূর্ণ যোগ করলে দ্রবণ থেকে ধূসর সিলভার অধঃক্ষিপ্ত হয় কেন? (If solid Ag is added to CuSO4 solution, no reaction takes place. However, if solid Cu is added to AgNO3 solution, why Ag is precipitated?)
উত্তর :
CuSO4(aq)+Ag(s)→ বিক্রিয়া ঘটে না
2AgNO3(aq)+Cu(s)→Cu(NO3)2(aq)+2Ag↓
অর্থাৎ কপার AgNO3 দ্রবণ থেকে Ag কে প্রতিস্থাপন করে।
সুতরাং সক্রিয়তার ক্রম হল- Cu>Ag
(ii) তুঁতের দ্রবণে Fe চূর্ণ যোগ করলে Cu এর লাল অধঃপড়ে।
CuSO4(aq)+Fe→FeSO4(aq)+Cu(s)∴Fe>Cu
(iii) FeSO4 দ্রবণে Zn চূর্ণ যোগ করলে Fe এর কালো অধঃক্ষেপ পড়ে।
FeSO4(aq)+Zn(s)→ZnSO4(aq)+Fe(s)
সুতরাং ৪টি পরীক্ষার সামগ্রিক সিদ্ধান্ত হল সক্রিয়তা সিরিজে ধাতুসমূহের সক্রিয়তার উচ্চ ক্ৰম সক্রিয়তা:
Ag কোন কোষের EMF এর মান তড়িৎদ্বারের প্রকৃতি, তাপমাত্রা এবং ঘনমাত্রার উপর নির্ভর করে। যদি কোন তড়িৎ রাসায়নিক কোষের দুটি তড়িৎ বিশ্লেষ্যের ঘনমাত্রা ভিন্ন হয় তাহলে নার্নষ্ট সমীকরণ ব্যবহার করে ঐ কোষের EMF মান নির্ণয় করা যায়। সমীকরণ নিম্নরূপে প্রতিষ্ঠা করা যায়- তড়িৎ রাসায়নিক কোষে বিক্রিয়ার ফলে পরিবাহীর মধ্য দিয়ে যখন বিদ্যুৎ প্রবাহ সংঘটিত হয় তখন কোষটি বৈদ্যুতিক কাজ সম্পন্ন করে। মনে করি, কোনো কোষের তড়িৎচ্চালক বল E এবং কোষের রিডক্স বিক্রিয়ায় n সংখ্যক ইলেকট্রন প্রয়োজন হয়। ফলে পরিবাহীতে n ফ্যারাডে (nF) তড়িৎ প্রবাহিত হয়। সুতরাং তড়িৎ প্রবাহ জনিত মোট কাজের পরিমাণ =nF কুলম্ব ×E ভোল্ট = nFE জুল তাপগতিবিদ্যার নিয়ম অনুযায়ী, তড়িৎ কোষে বিক্রিয়ার ফলে যে মুক্তশক্তির হ্রাস ঘটে, তা তড়িৎ প্রবাহ জনিত কাজের সমান, অর্থাৎ −ΔG=nFE [ΔG এর মান ঋণাত্মক হলে কোষ বিক্রিয়া স্বতঃস্ফূর্ত হবে কিন্তু EMF ধণাত্মক হলে কোষ বিক্রিয়া স্বতঃস্ফূর্ত হবে, ΔG=0 এবং Emf=0 হলে কোষ বিক্রিয়া সাম্যাবস্থায় থাকে] গিবস এর সমীকরণ মতে, ΔG=ΔG∘+RTlnk−nFE=−nFE0+RTInkE=E0−nFRTlnkE=E0−nF2.303RTlog[ বিক্রিয়ক আয়ন] [ উৎপাদ আয়ন] এ সমীকরণকে নার্নষ্ট সমীকরণ বলে। যার সাহায্যে কোন কোষের EMF মান নির্নয় করা যায়। যদি, T=25°C বা 298K হয় R=8.314JK−1 mol−1n=2 হয়। F=96500C তাহলে, উপরোক্ত সমীকরণটিকে নিম্নরূপে লেখা যায়- E=E0−20.0592log[বিক্রিয়ক আয়ন] [উৎপাদ আয়ন] বা, Ecell =Ecell 0−20.0592logK এখানে K হল সাম্যধ্রুবক। পাতলা দ্রবণের জন্য নার্নস্ট সমীকরণে সরাসরি আয়নের ঘনমাত্রা ব্যবহার করা যায় । কিন্তু ঘন দ্রবণের ক্ষেত্রে Activity co-cfficient এর মান 1 এর সমান হয় না বলে সেক্ষেত্রে সরাসরি ঘনমাত্রা ব্যবহার করে কোষ বিভব পরিমাপ করা যায় না। অন্যদিকে, ঘন দ্রবণের ক্ষেত্রে বিপরীত চার্জের আয়নসমূহের মধ্যে দুর্বল আকর্ষণ বল কাজ করে। তাই জারণ ও বিজারণে অংশ নেয়া মুক্ত আয়নের পরিমাণও কমে যায়। তাই বেশি ঘনমাত্রার (10−3M এর বেশি) দ্রবণের কোষ বিভব সম্পর্কে নার্নস্ট সমীকরণ সঠিক ধারণা দিতে পারে না। অর্থাৎ নার্নস্ট সমীকরণ মূলত পাতলা দ্রবণের জন্যই প্রযোজ্য। Mg∣∣Mg2+(0.13M)∣∣Ag+(1×10−4M)∣AgE∘Mg/Mg2+=+2.34V,E∘Ag/Ag2+=−0.8V উপরোক্ত তড়িৎ কোষ সংঘটিত বিক্রিয়া নিম্নরূপ : Mg→Mg2++2e−Mg+2Ag+→2eMg2++2Ag[Ag++e−→Ag]×2 যেহেতু, এখানে 2mole− আদান প্রদান হয়েছে এবং তাপমাত্রা 25°C তাই নার্নষ্ট সমীকরণটিকে নিম্নরূপে লেখা যায়- E=E0−20.0592log[Ag2+]2[Mg2+]=[E0Mg/Mg2+−E0Ag/Ag2+]−20.0592log(1×10−4)20.13=(2.34+0.8)−20.0592log(1×10−4)20.13=+2.96 V তড়িৎ রাসায়নিক সারি(Electrochemical Series) এক প্রকোষ্ঠ বিশিষ্ট তড়িৎ রাসায়নিক কোষের উদাহরণ হল, তড়িৎ বিশ্লেষ্য কোষ যা সাধারণত ধাতু নিষ্কাশনে এবং তড়িৎ বিশ্লেষণে ব্যবহৃত হয়। দুই প্রকোষ্ঠ বিশিষ্ট তড়িৎ রাসায়নিক কোষ হল: গ্যালভানিক কোষ এ ধরনের কোষ বিদ্যুৎ উৎপাদনে ব্যবহৃত হয়। যে রাসায়নিক কোষে একটি মাত্র তরল ব্যবহৃত হয় তাকে তরল কোষ বলে। যেমন- লেকল্যান্স কোষ এবং যে কোষে দুটি তরল ব্যবহৃত হয় তাকে দুই তরল কোষ বলে। যেমন- গ্যালভানিক কোষ। তবে শুষ্ক কোষে কোনো তরল পদার্থ ব্যবহৃত হয় না। ধাতু ক্ষয়ের অন্যতম উদাহরণ হল লোহার মরিচা পড়া। সাধারণত অবিশুদ্ধ লোহায় দ্রুত মরিচা পড়ে। এক্ষেত্রে অবিশুদ্ধ লোহার আয়রন অ্যানোড হিসেবে কাজ করে এবং ভেজালগুলো ক্যাথোড হিসেবে কাজ করে। যা নিষ্ক্রিয় তড়িৎদ্বার হিসেবে ব্যবহৃত হয়। আয়রন নিম্নরূপে আর্দ্র Fe2O3 গঠন করে। যা মরিচা হিসেবে পরিচিত। তাই বলা যায়, ধাতুর ক্ষয় একটি অ্যানোডিক জারণ প্রক্রিয়া। অ্যানোড (Anode) : Fe→Fe2++2e− ক্যাথোড (Cathode) : H2O+21O2+2e−→2OH−Fe2++2OH−→Fe(OH)2Fe(OH)2+21O2+H2O→Fe2O3⋅3H2Oপ্রশ্ন : নার্নষ্ট সমীকরণ প্রতিষ্ঠা কর। (Establish the Nernst’s Equation.)
উত্তর :
প্রশ্ন: নার্নস্ট সমীকরণের সীমাবদ্ধতা কী? (What are the limitations of Nernst’s equation?)
উত্তর :
প্রশ্নঃ 25°C তাপমাত্রায় নিম্নোক্ত কোষের EMF এর মান নির্ণয় কর। (Define the EMF value of the following cell at 25°C temperature.)
উত্তর :
প্রশ্নঃ H2 তড়িৎদ্বারের সংপেক্ষ বিভিন্ন তড়িৎদ্বারের বিজারণ বিভবের মান:-(Values of reduction potential of different electrode related toH2 electrode:)
উত্তর :
তড়িৎদ্বার অর্ধকোষ বিক্রিয়া প্রমাণ বিজারণ বিভব E0 (V) Li+/Li(s)K+/K(s)Ca2+/Ca(s)Na+/Na(s)Mg2+/Mg(s)Al3+/Al(s)Zn2+/Zn(s)Fe2/Fe(s)Sn2+/Su(s)Pb2+/Pb(s)H+/H2( g),PtCl−/AgCl(s),AgCl−/Hg2Cl2( s),HgCu2+/Cu(s)+0.28+0.34Ag+/Ag(s)Br−/Br2,PtCl−/Cl2,PtAu3+/Au Li++e→Li(s)K++e→K(s)Ca2++2e→Ca(s)Na4+e→Na(s)Mg2++2e→Mg(s)Al3++3e→Al(s)Zn2++2e→Zn(s)Fe2++2e→Fe(s)Sn2++2e→Su(s)Pb2++2e→Pb(s)H++e→21H2( g)AgCl+e−→Ag+Cl−Hg2Cl2+2e−→2Hg+2Cl−Cu2++2e−→Cu(s)I2+2e→2I−(aq)Hg2++2e−→Hg(I)Ag+e→Ag(s)Br2+2e→2Br−(aq)Cl2+2e→2Cl−(aq)Au3++3e→Au −3.05−2.93−2.87−2.71−2.37−1.66−0.76−0.44−0.14−0.130.00+0.22+0.54+0.79+0.80+1.08+1.36+1.50 প্রশ্নঃ এক প্রকোষ্ঠ এবং দুই প্রকোষ্ঠ বিশিষ্ট তড়িৎ রাসায়নিক কোষ বলতে কী বুঝ? (What is electrochemical cell with single & double compartments?)
উত্তর :
প্রশ্ন: এক তরল বিশিষ্ট কোষ এবং দুই তরল বিশিষ্ট কোষ বলতে কী বুঝ?(What is cell with single & double liquids?)
উত্তর :
প্রশ্ন : ধাতুর ক্ষয় একটি তড়িৎ রাসায়নিক প্রক্রিয়া, ব্যাখ্যা কর।(Explain- “Metallic corrosion is an electrochemical process”.)
উত্তর :
# বহুনির্বাচনী প্রশ্ন
তড়িৎদ্বার ও তড়িৎ কোষ লেখার সাংকেতিক চিহ্ন ও রীতি
তড়িৎদ্বার ও তড়িৎ কোষ যন্ত্রের কাজের প্রক্রিয়া বুঝতে তাদের সাংকেতিক চিহ্ন এবং রীতি গুরুত্বপূর্ণ। তড়িৎদ্বার এবং তড়িৎ কোষের মাধ্যমে বিদ্যুৎ পরিবহন ও সঞ্চালন ঘটানো হয়। এগুলির সাংকেতিক চিহ্ন এবং সঠিক রীতি ব্যবহার করলে এই যন্ত্রগুলির কাঠামো সহজে বোঝা যায় এবং এগুলি প্রযুক্তিগত চিত্রে সঠিকভাবে উপস্থাপন করা যায়।
তড়িৎদ্বারের সাংকেতিক চিহ্ন
তড়িৎদ্বার হল একটি সেমিকন্ডাক্টর উপাদান যা বিদ্যুৎ প্রবাহকে একটি নির্দিষ্ট দিক থেকে প্রবাহিত হতে সাহায্য করে। সাধারণত, তড়িৎদ্বারের সাংকেতিক চিহ্ন নিম্নরূপ:
পিএন জাংশন ডায়োড (PN Junction Diode):
একটি সোজা রেখা দিয়ে পিএন জংশন এবং একটি তীরচিহ্ন (arrow) নির্দেশ করে যে, এটি একটি ডায়োড।চিহ্ন:
একটি তীরচিহ্ন (arrow) এবং একটি সোজা রেখা।জেনার ডায়োড (Zener Diode):
সাধারণত একটি ডায়োডের চিহ্নের সাথে একটি বাঁকা রেখা সংযোজন করা হয়, যা এটি একটি জেনার ডায়োড নির্দেশ করে।চিহ্ন:
একটি সোজা রেখার উপর বাঁকা রেখা।এমটি (LED):
একটি আলোকনির্গমন ডায়োড (Light Emitting Diode) যেখানে একটি তীরচিহ্ন এবং একটি সাদা গোলাকার চিহ্ন প্রদর্শিত হয়।চিহ্ন:
একটি তীরচিহ্ন এবং একটি গোলাকার চিহ্নের সংমিশ্রণ।
তড়িৎ কোষের সাংকেতিক চিহ্ন
তড়িৎ কোষ হলো এমন একটি যন্ত্র যা রাসায়নিক শক্তিকে তড়িৎ শক্তিতে রূপান্তরিত করে। এটি সাধারণত দুটি পদার্থের মধ্যে রাসায়নিক বিক্রিয়া ঘটিয়ে তড়িৎ শক্তি উৎপন্ন করে। এর সাংকেতিক চিহ্ন সাধারণত ব্যাটারি বা সেল হিসেবে দেখা যায়।
প্রাথমিক তড়িৎ কোষ (Primary Cell):
এটি একবার চার্জ করার পর আর পুনরায় ব্যবহার করা যায় না। এর মধ্যে একটি সোজা রেখা থাকে যা একটি ছোট এবং বড় চক্রের সাথে যুক্ত থাকে।চিহ্ন:
একটি সোজা রেখা এবং দুটি গোলাকার চিহ্নের সংমিশ্রণ।আবর্তনযোগ্য তড়িৎ কোষ (Secondary Cell):
এটি চার্জ করা এবং পুনরায় ব্যবহৃত হতে পারে। এর মধ্যে সাধারণত একটি ছোট এবং বড় চক্রের চিহ্ন থাকে।চিহ্ন:
একটি সোজা রেখা এবং দুটি গোলাকার চিহ্নের সংমিশ্রণ যা পুনরায় চার্জ করার ক্ষমতা নির্দেশ করে।
সাংকেতিক চিহ্নের রীতি
তড়িৎদ্বার এবং তড়িৎ কোষের সাংকেতিক চিহ্নের রীতি অনুসরণ করতে হলে প্রতিটি যন্ত্রের বিশেষ গুণাবলী এবং সেগুলির মধ্যে সম্পর্ক বোঝা জরুরি। সঠিকভাবে সাংকেতিক চিহ্নগুলো লিখতে হবে যাতে তাদের অবস্থান, তার প্রবাহ এবং কাজের প্রক্রিয়া সহজে বোঝা যায়।
সারাংশ
তড়িৎদ্বার ও তড়িৎ কোষের সাংকেতিক চিহ্ন এবং রীতি বোঝার মাধ্যমে আমরা তড়িৎ সংকেতের প্রবাহ ও তড়িৎ শক্তির উৎপাদন সম্পর্কিত বিষয়গুলো সঠিকভাবে চিত্রিত করতে পারি। এসব চিহ্নগুলি প্রযুক্তিগত চিত্রে ব্যবহৃত হয় এবং বিভিন্ন বৈদ্যুতিক যন্ত্রের কর্মক্ষমতা প্রদর্শন করতে সাহায্য করে।
তড়িৎদ্বার বিভব
তড়িৎদ্বার বিভব (Electrostatic Potential) হলো সেই কাজের পরিমাণ যা একটি একক ধ্রুবক পরিমাণ ধনাত্মক আধান (positive charge) এক জায়গা থেকে অন্য জায়গায় স্থানান্তরের জন্য প্রয়োজন হয়। এটি আধানের জন্য এক স্থান থেকে অন্য স্থানে চলাচল করার সময় তড়িৎ শক্তির পরিবর্তনকে নির্দেশ করে। তড়িৎদ্বার বিভবের একক হলো ভোল্ট (Volt) এবং এর সূচক হলো \( V \)।
তড়িৎদ্বার বিভবের ধারণা
- ধারণা:
তড়িৎদ্বার বিভব হলো একটি স্থির জায়গায় আধানের অবস্থানগত শক্তি, যা একটি নির্দিষ্ট জায়গায় আধান রাখলে সে স্থান থেকে একটি একক ধ্রুবক আধান স্থানান্তর করতে যে শক্তি প্রয়োজন হয়, সেটি নির্ধারণ করে। গণনা:
তড়িৎদ্বার বিভবকে গণনা করা হয় নিম্নলিখিত সূত্রে:\[
V = \frac{W}{q}
\]যেখানে,
\(V\) হলো তড়িৎদ্বার বিভব,
\(W\) হলো স্থানান্তরের জন্য প্রয়োজনীয় কাজ,
\(q\) হলো আধানের পরিমাণ।- যতটা কার্যকর তড়িৎদ্বার বিভব:
একটি পজিটিভ আধানের ক্ষেত্রে, একটি নির্দিষ্ট স্থানে আধান রাখার সময় তার চারপাশে তড়িৎক্ষেত্র (Electric Field) সৃষ্টি হয়। তড়িৎদ্বার বিভব এই ক্ষেত্রের শক্তির পরিমাণ নির্ধারণ করে। - তড়িৎদ্বার বিভবের গুণাগুণ:
- তড়িৎদ্বার বিভব ভেক্টর নয়, এটি একটি স্কেলার পরিমাণ।
- এটি স্থানান্তরের কাজে ব্যবহৃত শক্তির পরিমাণের সাথে সম্পর্কিত।
- এটি প্রতিটি আধানের জন্য একক মানের মাধ্যমে নির্ধারণ করা যায়।
সারাংশ
তড়িৎদ্বার বিভব একটি মৌলিক তড়িৎধর্মী ধারণা, যা আধানের অবস্থানগত শক্তি নির্ধারণে সাহায্য করে। এটি তড়িৎক্ষেত্র এবং আধানের কার্যকলাপ বোঝাতে ব্যবহৃত হয় এবং শক্তির পরিমাণের সাথে সম্পর্কিত।
# বহুনির্বাচনী প্রশ্ন
সিস্টেমের কোনো প্রক্রিয়ার স্বতঃস্ফূর্ততার সাথে গিবস এর মুক্ত শক্তি হ্রাসের সম্পর্ক
গিবস এর মুক্ত শক্তি (Gibbs free energy) একটি থার্মোডাইনামিক্স সূচক যা একটি সিস্টেমের স্বতঃস্ফূর্ততা বা পরিবর্তন সম্ভবতা নির্দেশ করে। এটি তাপমাত্রা, চাপ এবং অন্যান্য অবস্থা পরিবর্তনের সাথে সম্পর্কিত থাকে এবং সিস্টেমের কাজের সামর্থ্য প্রাক্টিকালি পরিমাপ করার জন্য ব্যবহৃত হয়।
গিবস এর মুক্ত শক্তি এবং প্রক্রিয়া
গিবস এর মুক্ত শক্তির সাধারণ রূপ হল:
\[
G = H - TS
\]
এখানে,
- \( G \) হল গিবস এর মুক্ত শক্তি,
- \( H \) হল এনথালপি (total heat content),
- \( T \) হল তাপমাত্রা,
- \( S \) হল এন্ট্রপি (entropy)।
এটি একটি সিস্টেমের শক্তির পরিমাণ এবং তার স্থিতিস্থাপকতা (stability) নির্ধারণ করতে সহায়তা করে। একটি প্রক্রিয়া স্বতঃস্ফূর্ত হবে যদি তার গিবস মুক্ত শক্তি হ্রাস পায়।
স্বতঃস্ফূর্ততা এবং গিবস এর মুক্ত শক্তি
গিবস এর মুক্ত শক্তি কম হলে প্রক্রিয়া স্বতঃস্ফূর্তভাবে ঘটবে। এর জন্য গিবস এর মুক্ত শক্তির পরিবর্তন (\( \Delta G \)) এইভাবে নির্ধারণ করা হয়:
\[
\Delta G = \Delta H - T\Delta S
\]
এখানে,
- \( \Delta G \) হল গিবস মুক্ত শক্তির পরিবর্তন,
- \( \Delta H \) হল এনথালপির পরিবর্তন,
- \( \Delta S \) হল এন্ট্রপির পরিবর্তন।
যখন \( \Delta G \) নেতিবাচক হয়, তখন প্রক্রিয়া স্বতঃস্ফূর্তভাবে ঘটে। যদি \( \Delta G \) ধনাত্মক হয়, তবে প্রক্রিয়া স্বতঃস্ফূর্তভাবে ঘটবে না, এবং এটি বাইরের শক্তির সাহায্য নিয়ে ঘটতে পারে।
তাপমাত্রা এবং চাপের প্রভাব
গিবস মুক্ত শক্তির পরিবর্তন তাপমাত্রা এবং চাপের উপর নির্ভর করে। উচ্চ তাপমাত্রায়, এন্ট্রপির (S) প্রভাব বৃদ্ধি পায়, যা একটি প্রক্রিয়াকে স্বতঃস্ফূর্ত করে তুলতে পারে, এমনকি যদি এনথালপি (H) হ্রাস না হয়। তবে, নিম্ন তাপমাত্রায়, এনথালপির প্রভাব প্রধান হয়ে ওঠে এবং সেই কারণে কিছু প্রক্রিয়া স্বতঃস্ফূর্ত হতে পারে না।
সারাংশ
গিবস এর মুক্ত শক্তি প্রক্রিয়ার স্বতঃস্ফূর্ততা নির্দেশ করার জন্য একটি গুরুত্বপূর্ণ সূচক। একটি প্রক্রিয়া তখনই স্বতঃস্ফূর্ত হয় যখন তার গিবস মুক্ত শক্তি হ্রাস পায়, অর্থাৎ \( \Delta G \) নেতিবাচক হয়। এটি তাপমাত্রা, চাপ এবং অন্যান্য বাহ্যিক অবস্থার উপর নির্ভর করে, এবং সিস্টেমের স্থিতিস্থাপকতা ও শক্তি পরিবর্তন সংক্রান্ত গুরুত্বপূর্ণ তথ্য প্রদান করে।
Red-OX বিক্রিয়া, কোষ বিভব ও প্রমাণ কোষ বিভব
Red-OX বিক্রিয়া বা অক্সিডেশন-Reduction বিক্রিয়া হলো এক ধরনের রাসায়নিক বিক্রিয়া, যেখানে একটি পদার্থ ইলেকট্রন হারায় (অক্সিডাইজড হয়) এবং অন্যটি ইলেকট্রন গ্রহণ করে (রিডিউসড হয়)। এই বিক্রিয়া সাধারণত বৈদ্যুতিক শক্তির উৎপাদন বা সঞ্চয় ঘটাতে ব্যবহৃত হয়, যেমন ব্যাটারি ও গ্যালভানিক কোষে।
Red-OX বিক্রিয়া
Red-OX বিক্রিয়ার মূল লক্ষ্য হলো ইলেকট্রনের স্থানান্তর। সাধারণত, অক্সিডেশন একটি পদার্থের ইলেকট্রন হারানোর প্রক্রিয়া, এবং রিডাকশন একটি পদার্থের ইলেকট্রন গ্রহণের প্রক্রিয়া।
উদাহরণস্বরূপ, জলবস্তু NaCl উৎপাদনে:
\[
\text{Na} \rightarrow \text{Na}^+ + e^-
\]
(এখানে Na অক্সিডাইজড হয়, ইলেকট্রন হারায়)
এবং
\[
\text{Cl}_2 + 2e^- \rightarrow 2\text{Cl}^-
\]
(এখানে Cl রিডিউসড হয়, ইলেকট্রন গ্রহণ করে)
কোষ বিভব
কোষ বিভব (Cell Potential) একটি বৈদ্যুতিক পরিমাণ যা একটি রেডিওক্স বিক্রিয়ার মাধ্যমে তৈরি হয়। এটি কোষের দুইটি ইলেকট্রোডের মধ্যে থাকা বৈদ্যুতিক ভোল্টেজ বা ক্ষমতাকে নির্দেশ করে। কোষ বিভব বা ইলেকট্রোড বিভব মূলত প্রতিটি ইলেকট্রোডের গঠন এবং তার সাথে সম্পর্কিত পদার্থের অবস্থার উপর নির্ভর করে। কোষ বিভবের একক ভোল্ট (V)।
এটি সাধারণত নিম্নলিখিত সূত্রে প্রকাশ করা হয়:
\[
E_\text{cell} = E_\text{cathode} - E_\text{anode}
\]
এখানে,
- \(E_\text{cell}\) = কোষ বিভব
- \(E_\text{cathode}\) = কাথোডের বিভব (যেখানে রিডাকশন ঘটে)
- \(E_\text{anode}\) = আন্নোডের বিভব (যেখানে অক্সিডেশন ঘটে)
প্রমাণ কোষ বিভব
প্রমাণ কোষ বিভব (Standard Cell Potential) হলো একটি আদর্শ কোষের বিভব যা ২৫°C তাপমাত্রায় ১ মোলার কনসেন্ট্রেশন এবং ১ বার চাপের অবস্থায় পরিমাপ করা হয়। এর মান সাধারণত বই বা রেফারেন্স অনুযায়ী দেয়া থাকে এবং এই মান একটি কোষের সমস্ত বিক্রিয়াকে সূচিত করে।
এই প্রমাণ কোষ বিভব (এছাড়া কোষ বিভবের ধ্রুবক মান) ব্যবহৃত হয় রেডিওক্স বিক্রিয়ার প্রমাণ পরীক্ষা করার জন্য, যেমন গ্যালভানিক কোষের ভোল্টেজ হিসাব করা।
প্রমাণ কোষ বিভবের মান নির্ধারণ করা হয় গ্যালভানিক কোষের মাপের মাধ্যমে এবং এটি সাধারণত যথার্থ গড় ভোল্টেজ হিসেবে ব্যবহার করা হয়।
সারাংশ
Red-OX বিক্রিয়া ইলেকট্রন স্থানান্তরের মাধ্যমে ঘটে এবং এটি রাসায়নিক শক্তির উৎপাদন করে। কোষ বিভব একটি বৈদ্যুতিক পরিমাণ যা একটি রেডিওক্স বিক্রিয়া থেকে পাওয়া যায় এবং এটি কোষের দুইটি ইলেকট্রোডের মধ্যে থাকা ভোল্টেজকে নির্ধারণ করে। প্রমাণ কোষ বিভব হলো একটি আদর্শ কোষের বিভব যা পরীক্ষাগারে নির্দিষ্ট অবস্থায় মাপা হয় এবং এটি বিভিন্ন রাসায়নিক বিক্রিয়ার মূল্যায়নে ব্যবহৃত হয়।
তড়িৎদ্বার (Electrode) ও কোষের বিভব সংক্রান্ত নার্নস্ট সমীকরণ (Nernst Equation):
নার্নস্ট সমীকরণ একটি মৌলিক রসায়ন সমীকরণ যা একটি বৈদ্যুতিক কোষে কোনো নির্দিষ্ট আয়ন বা আণবিক প্রজাতির সমীকরণ কনসেনট্রেশন এবং বিভবের মধ্যে সম্পর্ক স্থাপন করে। এই সমীকরণটি এসিড-ক্ষার বিক্রিয়া, গ্যালভানিক কোষ, এবং বিভিন্ন ইলেকট্রোকেমিক্যাল সিস্টেমে ব্যবহৃত হয়।
নার্নস্ট সমীকরণ অনুযায়ী, কোনো নির্দিষ্ট আয়নের জন্য কোষ বিভব (Electrode potential) তার আয়নের কনসেনট্রেশন এবং পরিবেশগত শর্তের উপর নির্ভর করে। এই সমীকরণটি সঠিকভাবে কোষের ভিতরে বৈদ্যুতিক বিভবের মান নির্ধারণ করতে সাহায্য করে।
নার্নস্ট সমীকরণের সাধারণ রূপ:
\[
E = E^\circ - \frac{RT}{nF} \ln \left( \frac{[C_{\text{prod}}]}{[C_{\text{react}}]} \right)
\]
যেখানে,
- \( E \) হলো কোষের বিভব,
- \( E^\circ \) হলো মানক কোষ বিভব (standard electrode potential),
- \( R \) হলো গ্যাস কনস্ট্যান্ট (\(8.314 , \text{J/mol·K}\)),
- \( T \) হলো তাপমাত্রা (Kelvin),
- \( n \) হলো আণবিক ইলেকট্রনের সংখ্যা (এখানে প্রতিটি বিক্রিয়ায় অংশগ্রহণকারী ইলেকট্রনের সংখ্যা),
- \( F \) হলো ফারাডে কনস্ট্যান্ট (\( 96485 , \text{C/mol} \)),
- \( [C_{\text{prod}}] \) হলো পণ্য প্রজাতির কনসেনট্রেশন,
- \( [C_{\text{react}}] \) হলো প্রতিক্রিয়া প্রজাতির কনসেনট্রেশন।
নার্নস্ট সমীকরণের ব্যাখ্যা:
নার্নস্ট সমীকরণ কোষের বিভব নির্ধারণ করতে সাহায্য করে, যেখানে:
- \( E^\circ \) মানক বিভব, যা নির্দিষ্ট শর্তে নির্ধারিত হয়।
- তাপমাত্রা \( T \) এবং অন্যান্য কনসেনট্রেশন বিশ্লেষণ করে কোষের বিভবের পরিবর্তন হওয়া সম্ভব।
নার্নস্ট সমীকরণের সাহায্যে যে কোনো বৈদ্যুতিক কোষে আয়নগুলোর কনসেনট্রেশন থেকে বিভব হিসাব করা সম্ভব। এটি গ্যালভানিক কোষের কাজের ব্যাখ্যা, এসিড-ক্ষার বিক্রিয়া, এবং অন্যান্য বৈদ্যুতিন প্রক্রিয়ায় ব্যবহৃত হয়।
তড়িৎদ্বার ও এর প্রকারভেদ
তড়িৎদ্বার (Electrical Gate) হলো একটি বৈদ্যুতিন উপাদান যা বৈদ্যুতিক সিগন্যালের প্রবাহকে নিয়ন্ত্রণ করে। এটি একটি বৈদ্যুতিন ডিভাইস, যা সংকেতের প্রবাহ বন্ধ বা চালু করতে ব্যবহৃত হয়, এবং বিভিন্ন ধরণের তড়িৎ সিস্টেমে ব্যবহার হয় যেমন অ্যালগোরিদম, ডিজিটাল সার্কিট, বা অন্যান্য বৈদ্যুতিন সিস্টেমে।
তড়িৎদ্বারের প্রধান কাজ হচ্ছে সংকেত বা শক্তির প্রবাহ নিয়ন্ত্রণ করা, এবং এটি বিভিন্ন প্রকারে বিভক্ত হতে পারে।
তড়িৎদ্বারের প্রকারভেদ
- ডায়োড (Diode)
ডায়োড একটি মৌলিক তড়িৎদ্বার যা বৈদ্যুতিক প্রবাহকে একটি দিক থেকে অন্য দিকের দিকে প্রবাহিত করতে সাহায্য করে। এটি মূলত একমুখী তড়িৎ প্রবাহের জন্য ডিজাইন করা হয়েছে। এটি বৈদ্যুতিন উপাদান হিসেবে একধরনের সুইচের মতো কাজ করে। - ট্রানজিস্টর (Transistor)
ট্রানজিস্টর একটি অত্যন্ত গুরুত্বপূর্ণ তড়িৎদ্বার, যা ছোট সংকেত শক্তিকে বড় সংকেত শক্তিতে রূপান্তরিত করতে সক্ষম। এটি বিভিন্ন ডিজিটাল সার্কিটে ব্যবহৃত হয় এবং অ্যানালগ ও ডিজিটাল সিস্টেমে সুইচিং ফাংশন সম্পাদন করে। - থাইরিস্টর (Thyristor)
থাইরিস্টর একটি শক্তিশালী তড়িৎদ্বার, যা একটি নির্দিষ্ট তড়িৎ শক্তি পৌঁছানোর পর চালু হয় এবং সিগন্যাল বন্ধ করা পর্যন্ত থাকে। এটি প্রধানত পাওয়ার কন্ট্রোল সিস্টেমে ব্যবহৃত হয়। - আইজেকটর (Insulated-Gate Bipolar Transistor, IGBT)
আইজেকটর একটি আধুনিক তড়িৎদ্বার, যা উচ্চ ক্ষমতার স্যুইচিং এবং শক্তি নিয়ন্ত্রণের জন্য ব্যবহৃত হয়। এটি ট্রানজিস্টরের মতো কাজ করে কিন্তু আরও উচ্চ ক্ষমতা এবং সিগন্যাল নিয়ন্ত্রণে সক্ষম। - সোলিড স্টেট রিলে (Solid-State Relay)
এটি একটি ধরনের তড়িৎদ্বার যা সিগন্যাল নিয়ন্ত্রণের মাধ্যমে বৈদ্যুতিক সার্কিটকে চালু বা বন্ধ করতে ব্যবহৃত হয়, তবে এটি মেকানিক্যাল রিলের মতো যান্ত্রিক অংশ ছাড়াই কাজ করে। - মোসফেট (MOSFET)
এটি একটি ট্রানজিস্টরের উন্নত সংস্করণ, যা বিশেষভাবে সিগন্যাল সুইচিং এবং শক্তি নিয়ন্ত্রণের জন্য ব্যবহৃত হয়। এর মাধ্যমে অত্যন্ত দ্রুত সুইচিং এবং কম শক্তি খরচে উচ্চ দক্ষতা অর্জন সম্ভব।
সারাংশ
তড়িৎদ্বার হলো একটি গুরুত্বপূর্ণ বৈদ্যুতিন উপাদান, যা বৈদ্যুতিক সংকেতের প্রবাহ নিয়ন্ত্রণ করে। এর বিভিন্ন প্রকার রয়েছে, প্রতিটি প্রকারের বিশেষ কার্যক্ষমতা ও সুবিধা রয়েছে, যা সিস্টেমের চাহিদার উপর নির্ভর করে ব্যবহৃত হয়।
# বহুনির্বাচনী প্রশ্ন
9.475g
11.475g
10.475g
8.475g
ধাতু ধাতব আয়ন তড়িৎদ্বার গঠন একটি গুরুত্বপূর্ণ প্রক্রিয়া যা তড়িৎ পরিবাহিতা এবং ধাতব বৈশিষ্ট্যগুলো বুঝতে সাহায্য করে। এই প্রক্রিয়াটি মূলত ধাতু বা ধাতব উপাদানের মধ্যে ইলেকট্রনের গতি এবং সঞ্চালনের প্রক্রিয়াকে বোঝায়।
ধাতু ধাতব আয়ন তড়িৎদ্বার গঠনের প্রক্রিয়া
১. ধাতু এবং ধাতব আয়ন:
ধাতু এমন উপাদান, যা ইলেকট্রন ছেড়ে দেয় এবং ধাতব আয়ন গঠন করে। ধাতুর অণুতে অবস্থিত বাইরের ইলেকট্রনগুলি খুবই দুর্বলভাবে আঠাল থাকে, যার ফলে এগুলো সহজে ছেড়ে দিয়ে ধাতব আয়ন তৈরি করে। এই প্রক্রিয়াকে বলা হয় অক্সিডেশন। ধাতব আয়ন, যেগুলো ইতিবাচক আধান ধারণ করে, পরমাণু বা অণুর মধ্যে থেকে বেরিয়ে গিয়ে পরমাণু কাঠামোর বাইরে বসবাস করে।
২. তড়িৎদ্বার গঠন:
ধাতু যখন তড়িৎ প্রবাহের সাথে সংযুক্ত হয়, তখন ধাতব আয়ন এবং ইলেকট্রনের মধ্যে এক ধরনের ইন্টারঅ্যাকশন ঘটে। ধাতব আয়ন ইতিবাচক চার্জ ধারণ করে এবং এই আয়নগুলো ধাতু কাঠামোতে স্থির থাকে, যা বৈদ্যুতিন পরিবাহিতাকে সহজতর করে তোলে। একই সঙ্গে, ভেতরে থাকা নিরপেক্ষ ইলেকট্রনগুলো ধাতু কাঠামোর মধ্যে স্বাধীনভাবে চলাচল করতে পারে, যার ফলে ধাতুর তড়িৎ পরিবাহিতা বৃদ্ধি পায়।
৩. ধাতব আয়ন এবং ইলেকট্রনের পরিবাহিতা:
ধাতব আয়ন এবং ইলেকট্রনের মধ্যে একটি ইলেকট্রন সমুদ্র গঠন হয়, যা পুরো ধাতুর মধ্য দিয়ে চলাচল করে। এই সমুদ্র পরিবাহিতাকে আরো উন্নত করে, কারণ এটি তড়িৎ প্রবাহের জন্য একটি অবাধ পথ প্রদান করে। ধাতব আয়ন গঠন প্রক্রিয়ার মাধ্যমে এই সমুদ্র আরও স্থিতিশীল হয়।
ধাতু ধাতব আয়ন তড়িৎদ্বারের বৈশিষ্ট্য
- তড়িৎ পরিবাহিতা:
ধাতুর মধ্যে তড়িৎ পরিবাহিতা ধাতব আয়ন এবং স্বাধীনভাবে চলাচলকারী ইলেকট্রনের গতি এবং গতিশীলতার উপর নির্ভরশীল। যত বেশি পরিমাণে স্বাধীন ইলেকট্রন থাকবে, তত বেশি তড়িৎ পরিবাহিতা অর্জিত হবে। - গরম এবং ঠান্ডা পরিবাহিতা:
তাপমাত্রা বাড়ানোর সাথে সাথে ধাতুর মধ্যে ধাতব আয়ন এবং ইলেকট্রনের গতির মধ্যে পরিবর্তন ঘটতে পারে। উচ্চ তাপমাত্রা ধাতব আয়নের গতি বাড়িয়ে দেয়, যার ফলে তড়িৎ পরিবাহিতা কিছুটা কমে যেতে পারে।
সারাংশ
ধাতু ধাতব আয়ন তড়িৎদ্বার গঠনে ধাতুর অণু থেকে ইলেকট্রন মুক্তি পেয়ে ধাতব আয়ন সৃষ্টি করে। ধাতব আয়ন এবং স্বাধীন ইলেকট্রন একটি ইলেকট্রন সমুদ্র গঠন করে, যা তড়িৎ প্রবাহের মাধ্যমে ধাতুর পরিবাহিতাকে উন্নত করে। এই প্রক্রিয়া ধাতুর বৈদ্যুতিন এবং তাপ পরিবাহিতা নির্ধারণে গুরুত্বপূর্ণ ভূমিকা পালন করে।
# বহুনির্বাচনী প্রশ্ন
9.475g
11.475g
10.475g
8.475g
রাসায়নিক কোষ ব্যবহার করে রাসায়নিক শক্তিকে বিদ্যুৎ শক্তিতে রূপান্তর
রাসায়নিক কোষ (Chemical Cell) হলো এমন একটি ডিভাইস যা রাসায়নিক প্রতিক্রিয়া ব্যবহার করে রাসায়নিক শক্তিকে বিদ্যুৎ শক্তিতে রূপান্তরিত করে। এটি মূলত দুটি ধাতু বা ইলেকট্রোলাইট দ্বারা তৈরি একটি সিস্টেম, যেখানে একটি ধাতু জারণ হয় (অথবা ধাতু আয়ন থেকে বিদ্যুৎ গ্রহণ করে) এবং অন্যটি বিজারণ ঘটে (অথবা ইলেকট্রন গ্রহণ করে)। রাসায়নিক কোষে বিদ্যুৎ প্রবাহ তৈরি করার জন্য, দুটি অর্ধবিক্রিয়া (যেমন জারণ এবং বিজারণ) একে অপরকে পরিপূরক হিসেবে কাজ করে।
রাসায়নিক কোষের মধ্যে প্রধানত দুটি মৌলিক অংশ থাকে:
- অ্যানোড (Anode): এটি ধাতুর অংশ যা জারণ (Oxidation) প্রতিক্রিয়া ঘটায় এবং ইলেকট্রন ছেড়ে দেয়।
- ক্যাথোড (Cathode): এটি ধাতুর অংশ যা বিজারণ (Reduction) প্রতিক্রিয়া ঘটায় এবং ইলেকট্রন গ্রহণ করে।
এই প্রতিক্রিয়াগুলোর মাধ্যমে রাসায়নিক শক্তি বিদ্যুৎ শক্তিতে রূপান্তরিত হয়। সঠিকভাবে কাজ করার জন্য দুটি অ্যানোড এবং ক্যাথোডকে একটি ইলেকট্রোলাইট দিয়ে আলাদা করা হয়।
উদাহরণ: ড্যানিয়েল সেল (Daniel Cell)
ড্যানিয়েল সেল একটি সাধারণ রাসায়নিক কোষের উদাহরণ যা কপার (Cu) এবং জিঙ্ক (Zn) দ্বারা তৈরি। এটি একটি অত্যন্ত পরিচিত রাসায়নিক কোষ যেখানে জিঙ্ক ধাতু অ্যানোড হিসেবে কাজ করে এবং কপার ধাতু ক্যাথোড হিসেবে কাজ করে।
প্রক্রিয়া:
- অ্যানোড (Zn): এখানে, জিঙ্ক (Zn) দুটি ইলেকট্রন হারিয়ে জিঙ্ক আয়ন (Zn²⁺) তৈরি করে।
\[
\text{Zn} \rightarrow \text{Zn}^{2+} + 2e^-
\] - ক্যাথোড (Cu): এখানে, কপার আয়ন (Cu²⁺) দুটি ইলেকট্রন গ্রহণ করে কপার ধাতু (Cu) জমা হয়।
\[
\text{Cu}^{2+} + 2e^- \rightarrow \text{Cu}
\]
এই প্রতিক্রিয়াগুলোর মাধ্যমে রাসায়নিক শক্তি বিদ্যুৎ শক্তিতে রূপান্তরিত হয়, এবং এটি বিদ্যুৎ সরবরাহ করে।
সারাংশ
রাসায়নিক কোষ রাসায়নিক শক্তিকে বিদ্যুৎ শক্তিতে রূপান্তরিত করার একটি গুরুত্বপূর্ণ মাধ্যম। এই কোষের মাধ্যমে, রাসায়নিক প্রতিক্রিয়া যেমন জারণ এবং বিজারণ ঘটে, যা বিদ্যুৎ প্রবাহ তৈরি করে। ড্যানিয়েল সেল এর একটি সাধারণ উদাহরণ, যেখানে জিঙ্ক এবং কপার ব্যবহার করা হয়। রাসায়নিক কোষগুলি বিভিন্ন শিল্প এবং বৈজ্ঞানিক ক্ষেত্রেও ব্যাপকভাবে ব্যবহৃত হয়, যেমন ব্যাটারি উৎপাদন এবং শক্তি সংরক্ষণে।
# বহুনির্বাচনী প্রশ্ন
# বহুনির্বাচনী প্রশ্ন
তড়িৎ বিশ্লেষ্য কোষ ও গ্যালভানিক কোষের বৈশিষ্ট্য ও পার্থক্য
তড়িৎ বিশ্লেষ্য কোষ (Electrolytic Cell)
তড়িৎ বিশ্লেষ্য কোষ এমন একটি বৈদ্যুতিন সেল যা বাইরের বৈদ্যুতিক শক্তি প্রয়োগের মাধ্যমে রাসায়নিক বিক্রিয়া ঘটায়। এই কোষের মধ্যে বাইরের বাহ্যিক শক্তি সরবরাহ করা হয়, যার ফলে অক্সিডেশন এবং বিজারণ প্রতিক্রিয়া ঘটে। তড়িৎ বিশ্লেষ্য কোষে, ইলেকট্রনিক প্রবাহ চালিত করার জন্য বৈদ্যুতিক শক্তির প্রয়োজন হয়, যার ফলে পদার্থের রাসায়নিক রূপান্তর ঘটে।
বৈশিষ্ট্য:
- বাহ্যিক বিদ্যুৎ সরবরাহ প্রয়োজন।
- এই কোষে অক্সিডেশন প্রক্রিয়া ধনাত্মক điệnদ্বার (positive electrode)এ ঘটে এবং বিজারণ প্রক্রিয়া ঘটে ঋণাত্মক điệnদ্বারে (negative electrode)।
- সাধারণত ধাতু উত্তোলন বা রাসায়নিক প্রতিক্রিয়া উদ্দীপিত করার জন্য ব্যবহৃত হয়।
- উদাহরণ: জল থেকে হাইড্রোজেন ও অক্সিজেন গ্যাস উৎপাদন, রূপা ও সোনার পরিশোধন।
গ্যালভানিক কোষ (Galvanic Cell)
গ্যালভানিক কোষ একটি বৈদ্যুতিন সেল যা রাসায়নিক প্রতিক্রিয়ার মাধ্যমে বৈদ্যুতিক শক্তি উৎপন্ন করে। এই কোষে রাসায়নিক প্রতিক্রিয়ার ফলস্বরূপ স্বতঃস্ফূর্তভাবে বিদ্যুৎ উৎপন্ন হয়, কোন বাহ্যিক বৈদ্যুতিক শক্তির প্রয়োজন নেই। গ্যালভানিক কোষে অক্সিডেশন প্রক্রিয়া একটি ধনাত্মক điệnদ্বারে এবং বিজারণ প্রক্রিয়া ঋণাত্মক điệnদ্বারে ঘটে।
বৈশিষ্ট্য:
- বাহ্যিক বিদ্যুৎ সরবরাহের প্রয়োজন নেই, স্বতঃস্ফূর্তভাবে বিদ্যুৎ উৎপন্ন হয়।
- এই কোষটি একটি বিদ্যুৎ উৎপাদনকারী কোষ, যেখানে রাসায়নিক শক্তি বৈদ্যুতিক শক্তিতে রূপান্তরিত হয়।
- উদাহরণ: দানাদার ব্যাটারি, সেলফ-চার্জিং ব্যাটারি, টেস্টিং সেলস।
পার্থক্য
| বৈশিষ্ট্য | তড়িৎ বিশ্লেষ্য কোষ | গ্যালভানিক কোষ |
|---|---|---|
| বিদ্যুতের উৎস | বাহ্যিক শক্তির উৎস (যেমন ব্যাটারি) | স্বতঃস্ফূর্ত রাসায়নিক প্রতিক্রিয়া |
| কাজের উদ্দেশ্য | রাসায়নিক রূপান্তর সৃষ্টি করা | বিদ্যুৎ উৎপন্ন করা |
| পোলারিটি | ধনাত্মক电দ্বারে অক্সিডেশন, ঋণাত্মক电দ্বারে বিজারণ | ধনাত্মক电দ্বারে বিজারণ, ঋণাত্মক电দ্বারে অক্সিডেশন |
| প্রয়োগ | রূপান্তর বা পরিশোধন (যেমন ধাতু উত্তোলন) | বিদ্যুৎ উৎপাদন বা শক্তি সঞ্চয় |
| বিদ্যুৎ উৎপাদন | বিদ্যুৎ উৎপন্ন হয় না | বিদ্যুৎ উৎপন্ন হয় |
সারাংশ
তড়িৎ বিশ্লেষ্য কোষ এবং গ্যালভানিক কোষের মধ্যে প্রধান পার্থক্য হল বিদ্যুৎ উৎপাদনের প্রক্রিয়া এবং বাহ্যিক শক্তির প্রয়োগের প্রয়োজনীয়তা। তড়িৎ বিশ্লেষ্য কোষ বাহ্যিক শক্তির সাহায্যে রাসায়নিক রূপান্তর ঘটায়, আর গ্যালভানিক কোষ রাসায়নিক শক্তি থেকে স্বতঃস্ফূর্তভাবে বিদ্যুৎ উৎপন্ন করে।
# বহুনির্বাচনী প্রশ্ন
লেড স্টোরেজ ব্যাটারি ব্যবহারের সুবিধা ও অসুবিধা
লেড স্টোরেজ ব্যাটারি সাধারণত লিড-অ্যাসিড ব্যাটারি নামে পরিচিত এবং এটি মূলত রিচার্জেবল ব্যাটারি হিসেবে ব্যবহৃত হয়। এর প্রধান ব্যবহার বিদ্যুৎ সংরক্ষণ, গাড়ির ব্যাটারি এবং অন্যান্য শক্তি সঞ্চয়ের ব্যবস্থায় হয়ে থাকে।
সুবিধাসমূহ:
- কম দাম: লেড স্টোরেজ ব্যাটারির দাম সাধারণত লিথিয়াম ব্যাটারির তুলনায় অনেক কম।
- বিশ্বস্ততা: এটি দীর্ঘকাল ধরে ব্যবহৃত এবং বিশ্বস্ত প্রযুক্তি, তাই এর কার্যকারিতা অনেক পরীক্ষিত।
- সহজ রক্ষণাবেক্ষণ: লেড স্টোরেজ ব্যাটারি কম সময়ে রিচার্জ করা যায় এবং এর রক্ষণাবেক্ষণ তুলনামূলকভাবে সহজ।
- উচ্চ শক্তি ধারণ ক্ষমতা: এই ব্যাটারিগুলিতে উচ্চ শক্তি ধারণের ক্ষমতা থাকে, যা দীর্ঘ সময় ধরে শক্তি সরবরাহ করতে সক্ষম।
অসুবিধাসমূহ:
- বৃহৎ আকার ও ভারী: লেড স্টোরেজ ব্যাটারি তুলনামূলকভাবে ভারী এবং আকারে বৃহৎ, যা স্থান এবং পরিবহণের সমস্যা সৃষ্টি করতে পারে।
- কম জীবনকাল: অন্যান্য ব্যাটারির তুলনায় লেড স্টোরেজ ব্যাটারির জীবনকাল অপেক্ষাকৃত কম। এটি বেশি সাইকেল চার্জ/ডিসচার্জ করতে পারে না।
- নিখরচায় শক্তির ক্ষতি: অনেক সময় লেড স্টোরেজ ব্যাটারি শক্তি উৎপাদন এবং ব্যবহার পরিমাণে কিছুটা নষ্ট হয়, যার ফলে দক্ষতা কমে যায়।
- পরিবেশগত প্রভাব: লেড স্টোরেজ ব্যাটারি পরিবেশের জন্য ক্ষতিকর হতে পারে, কারণ এতে ব্যবহৃত লেড (lead) পরিবেশ দূষণকারী পদার্থ।
লিথিয়াম ব্যাটারি ব্যবহারের সুবিধা ও অসুবিধা
লিথিয়াম ব্যাটারি আধুনিক প্রযুক্তিতে ব্যবহৃত সবচেয়ে জনপ্রিয় ব্যাটারি প্রযুক্তি। এটি স্মার্টফোন, ল্যাপটপ, ইলেকট্রিক গাড়ি এবং আরও অনেক প্রযুক্তিতে ব্যবহৃত হয়।
সুবিধাসমূহ:
- উচ্চ শক্তি ঘনত্ব: লিথিয়াম ব্যাটারি উচ্চ শক্তি ঘনত্ব রাখে, যা তুলনামূলকভাবে ছোট আকারে অনেক বেশি শক্তি সঞ্চয় করতে সক্ষম।
- দীর্ঘ জীবনকাল: এটি বেশিরভাগ ব্যাটারির তুলনায় দীর্ঘস্থায়ী এবং বেশি সাইকেল চার্জ/ডিসচার্জ সহ্য করতে পারে।
- কম ওজন এবং আকার: লিথিয়াম ব্যাটারি অনেক বেশি হালকা ও কম আকারের, যা আরও বেশি কার্যকর এবং সুবিধাজনক।
- উচ্চ কার্যক্ষমতা: এটি দ্রুত চার্জ হতে পারে এবং দক্ষতা অনেক বেশি থাকে, যা দ্রুত শক্তি সরবরাহের সুবিধা দেয়।
অসুবিধাসমূহ:
- দাম: লিথিয়াম ব্যাটারি বেশ ব্যয়বহুল, যা অনেক ক্ষেত্রে লেড স্টোরেজ ব্যাটারির তুলনায় বেশি খরচের কারণ হতে পারে।
- ব্যাটারি নিরাপত্তা: অতিরিক্ত চার্জ বা তাপমাত্রার কারণে লিথিয়াম ব্যাটারি থেকে আগুন বা বিস্ফোরণ ঘটতে পারে, যা নিরাপত্তার জন্য ঝুঁকি তৈরি করে।
- পরিবেশগত প্রভাব: লিথিয়াম ব্যাটারি ব্যবহারের জন্য খনিজের খনন পরিবেশগতভাবে ক্ষতিকর হতে পারে, এবং এটি পুনঃব্যবহারযোগ্য হতে পারে না, যার কারণে পুনঃব্যবহারের সমস্যা থাকে।
- সংগ্রহের অভাব: বাজারে লিথিয়াম ব্যাটারি উৎপাদনকারী কোম্পানিগুলোর মেটাল উৎস এবং প্রয়োজনীয় খনিজ খননের সমস্যা রয়েছে, যার ফলে ব্যাটারি সরবরাহে মাঝে মাঝে ঘাটতি দেখা দেয়।
এইভাবে, লেড স্টোরেজ ও লিথিয়াম ব্যাটারি ব্যবহারের সুবিধা এবং অসুবিধাগুলি নির্ভর করে ব্যবহারের প্রয়োজনীয়তা এবং প্রযুক্তির উপর।
# বহুনির্বাচনী প্রশ্ন
লিথিয়াম মেটাল অক্সাইড (LiMO2) থেকে লিথিয়াম আয়ন (Li+ )বের হয়ে যাওয়া
লিথিয়াম আয়ন(Li+) এর গ্রাফাইটের দুই স্তরের মধ্যে প্রবেশ করা
লিথিয়াম আয়ন (Li+) এর জৈব দ্রাবকের মধ্যে বিচরন করা
লিথিয়াম আয়ন (Li+) দ্রবণে সলভেটেড হওয়া
মেটাল অক্সাইড পৃষ্ঠে লিথিয়াম আয়ন(Li+) জমা হওয়া
ফুয়েল সেল হচ্ছে এমন একটি তড়িৎ রাসায়নিক কোষ যেখানে হাইড্রোজেন এবং অক্সিজেনের বিক্রিয়ায় সরাসরি ডিসি কারেন্ট হয় এবং বাই প্রোডাক্ট হিসেবে পানি এবং তাপ উৎপন্ন হয়। অন্যান্য সাধারণ তড়িৎ রাসায়নিক কোষের মতো ফুয়েল সেলেও অন্যোড এবং ক্যাথোডের মাঝে ইলেক্ট্রোলাইট থাকে। এর গঠন অনেকটা স্যান্ডউইচের মতো। অন্যোডে হাইড্রোজেন ভেঙ্গে তৈরি হয় প্রোটন (H+) এবং ইলেকট্রন (e-)। প্রোটনটি ইলেক্ট্রোলাইটের মধ্য দিয়ে ক্যাথোডে গিয়ে অক্সিজেনের সাথে মিশে তৈরি করে পানি। আর এই ইলেকট্রনের চলাফেরায় তৈরি হয় বিদ্যুত।
প্রকারভেদ
ফুয়েল সেল বিভিন্ন প্রকারের হয়ে থাকে।[১] তাদের মধ্যে উল্লেখ্য হলঃ
- প্রোটোন বিনিময়কারী ফুয়েল সেল
- প্রত্যক্ষ ব্যবহৃত মিথানল ফুয়েল সেল অথবা মিথানল ফুয়েল সেল,
- সলিড অক্সাইড ফুয়েল সেল
- বিগলিত কার্বনেট ফুয়েল সেল
- এলকালাইন বা ক্ষারধর্মী ফুয়েল সেল
রাসায়নিক বিক্রিয়া
ফুয়েল সেলে সংগঠিত রাসায়নিক বিক্রিয়া হচ্ছেঃ
ফুয়েল সেল
- অ্যানোডঃ 2H2=4H+ + 4e-
- ক্যাথোডঃ O2+4H++4e-=2H2O
- নীট বিক্রিয়াঃ 2H2+O2=2H2O
একটি সাধারণ ফুয়েল সেলে উৎপাদিত বিভব শক্তির পরিমাণ ০.৭ ভোল্ট।
# বহুনির্বাচনী প্রশ্ন
আপনি "ফুয়েল সেলের অ্যানোড, ক্যাথোড, ফুয়েল সেল ও ব্যাটারির মধ্যে তুলনা" বিষয়টি নিয়ে একটি টিউটোরিয়াল লিখতে চান, ভূমিকা ও উপসংহার বাদে। আমি কিছু গুরুত্বপূর্ণ বিষয়গুলো তুলে ধরছি যা আপনাকে এই টিউটোরিয়াল লিখতে সহায়তা করবে।
ফুয়েল সেলের অ্যানোড এবং ক্যাথোড
অ্যানোড:
ফুয়েল সেলে অ্যানোড হল সেই অংশ যেখানে ধরা হয় ধ্বংসাত্মক রাসায়নিক প্রতিক্রিয়া। এটি হাইড্রোজেন গ্যাসকে আয়নিত হাইড্রোজেন আয়ন (H⁺) এ পরিণত করে, যা সেলের চলার জন্য গুরুত্বপূর্ণ। অ্যানোডে একটি অক্সিডেশন প্রতিক্রিয়া ঘটে, যার ফলে ইলেকট্রন মুক্ত হয় এবং সেগুলি বাহ্যিক সার্কিটের মাধ্যমে ক্যাথোডে চলে যায়।
ক্যাথোড:
ক্যাথোড হল সেলের সেই অংশ যেখানে রিডাকশন প্রতিক্রিয়া ঘটে। এটি সেলের মাধ্যমে প্রবাহিত ইলেকট্রনের গ্রহণকর্তা। ক্যাথোডে সাধারণত অক্সিজেন গ্যাস (O₂) বা বাতাস থেকে অক্সিজেন আয়ন (O²⁻) গ্রহণ করা হয় এবং এটি হাইড্রোজেন আয়ন (H⁺) সঙ্গে মিলিত হয়ে পানি (H₂O) উৎপন্ন করে।
ফুয়েল সেল ও ব্যাটারির মধ্যে তুলনা
ফুয়েল সেল:
ফুয়েল সেল একটি রাসায়নিক শক্তি উৎপন্নকারী ডিভাইস যা একটি নির্দিষ্ট জ্বালানির (যেমন হাইড্রোজেন) অক্সিডেশন ও রিডাকশন প্রতিক্রিয়ার মাধ্যমে বৈদ্যুতিক শক্তি উৎপন্ন করে। এটি একসাথে শক্তি উৎপন্ন এবং সরবরাহ করতে সক্ষম, অর্থাৎ একদিকে এটি শক্তি উৎপন্ন করে, অন্যদিকে এটি নির্দিষ্ট ধরণের গ্যাস বা রাসায়নিক উপাদান (যেমন হাইড্রোজেন বা অক্সিজেন) গ্রহণ করে।
ব্যাটারি:
ব্যাটারি একটি শক্তির সঞ্চয়কারী ডিভাইস যা এক বা একাধিক বৈদ্যুতিক সেল ধারণ করে এবং একটি নির্দিষ্ট সময় পর্যন্ত বিদ্যুৎ প্রদান করে। এটি একটি সিঙ্ক্রোনাইজড রিডাকশন ও অক্সিডেশন প্রক্রিয়ায় বিদ্যুৎ তৈরি করে, তবে যখন ব্যাটারি শেষ হয়, তখন এটি আর বিদ্যুৎ উৎপন্ন করতে পারে না যতক্ষণ না এটি আবার চার্জ করা হয়।
তুলনা:
- শক্তি উৎস: ফুয়েল সেল ধারাবাহিকভাবে শক্তি উৎপন্ন করে, যেখানে ব্যাটারি সঞ্চিত শক্তি থেকে শক্তি প্রদান করে।
- চার্জিং: ফুয়েল সেল স্বয়ংক্রিয়ভাবে শক্তি উৎপন্ন করতে থাকে, তবে ব্যাটারি নির্দিষ্ট পরিমাণ শক্তি প্রদান করার পর পুনরায় চার্জ করতে হয়।
- জ্বালানি: ফুয়েল সেল নির্দিষ্ট জ্বালানি ব্যবহার করে (যেমন হাইড্রোজেন), যেখানে ব্যাটারি রাসায়নিক শক্তি সঞ্চিত রাখে।
- মেয়াদ: ফুয়েল সেল দীর্ঘ মেয়াদী এবং একটি অবিচ্ছিন্ন শক্তি উৎস হতে পারে, তবে ব্যাটারি সীমিত মেয়াদ এবং পুনঃচার্জযোগ্য।
সারাংশ
এই টিউটোরিয়ালে আমরা ফুয়েল সেলের অ্যানোড ও ক্যাথোড এবং ফুয়েল সেল ও ব্যাটারির মধ্যে তুলনা করেছি। ফুয়েল সেল শক্তি উৎপাদন করতে থাকে, যেখানে ব্যাটারি একটি নির্দিষ্ট পরিমাণ শক্তি সঞ্চিত রাখে। উভয় সিস্টেমের কার্যপদ্ধতি আলাদা হলেও, এদের লক্ষ্য একই — বৈদ্যুতিক শক্তি উৎপাদন।
হাইড্রোজেন ফুয়েল সেলের গঠন
হাইড্রোজেন ফুয়েল সেল এমন একটি বৈদ্যুতিক যন্ত্র যা হাইড্রোজেন এবং অক্সিজেনের মধ্যে সংঘটিত রাসায়নিক বিক্রিয়ার মাধ্যমে বিদ্যুৎ উৎপন্ন করে। ফুয়েল সেলের মূল গঠনটি কয়েকটি অংশ নিয়ে গঠিত, যেমন:
১. এনোড (Anode):
এটি হাইড্রোজেনের উপস্থিতিতে থাকে এবং হাইড্রোজেনের বিক্রিয়া ঘটাতে সহায়ক। এনোডে সাধারণত একটি প্ল্যাটিনাম ক্যাটালিস্ট ব্যবহার করা হয়, যা হাইড্রোজেনকে প্রোটন ও ইলেকট্রনে ভাগ করে।
২. ক্যাথোড (Cathode):
ক্যাথোড অক্সিজেন গ্রহণ করে এবং প্রোটন ও ইলেকট্রনের সাথে বিক্রিয়া ঘটিয়ে পানি উৎপন্ন করে। এটি বিক্রিয়ার শেষে উৎপন্ন পানি এবং তাপ সরবরাহের জন্য সহায়ক।
৩. ইলেকট্রোলাইট (Electrolyte):
ইলেকট্রোলাইট প্রোটনগুলোকে এনোড থেকে ক্যাথোডের দিকে চলতে সাহায্য করে। এটি ফুয়েল সেলের বিক্রিয়া বজায় রাখতে এবং পুরো প্রক্রিয়াটি কার্যকর রাখতে গুরুত্বপূর্ণ ভূমিকা পালন করে।
৪. বাইপোলার প্লেটস (Bipolar Plates):
বাইপোলার প্লেটগুলি জ্বালানি ও অক্সিজেনের বণ্টন ও চলাচল নিয়ন্ত্রণ করে এবং তাপ প্রবাহিত করতে সহায়ক।
হাইড্রোজেন ফুয়েল সেলে সংঘটিত রাসায়নিক বিক্রিয়া
হাইড্রোজেন ফুয়েল সেলে প্রধানত দুটি রাসায়নিক বিক্রিয়া সংঘটিত হয়:
১. এনোডে সংঘটিত বিক্রিয়া:
এনোডে হাইড্রোজেন গ্যাস (H₂) ক্যাটালিস্টের সাহায্যে প্রোটন (H⁺) ও ইলেকট্রনে (e⁻) বিভক্ত হয়।
\[
\text{H}_{2} \rightarrow 2\text{H}^{+} + 2\text{e}^{-}
\]
২. ক্যাথোডে সংঘটিত বিক্রিয়া:
ক্যাথোডে অক্সিজেন গ্যাস (O₂), প্রোটন এবং ইলেকট্রন বিক্রিয়া করে পানি (H₂O) উৎপন্ন করে।
\[
\text{O}{2} + 4\text{H}^{+} + 4\text{e}^{-} \rightarrow 2\text{H}{2}\text{O}
\]
সম্মিলিত বিক্রিয়া:
হাইড্রোজেন ফুয়েল সেলের সম্মিলিত বিক্রিয়া হচ্ছে:
\[
\text{2H}{2} + \text{O}{2} \rightarrow 2\text{H}_{2}\text{O}
\]
এই বিক্রিয়ার মাধ্যমে বিদ্যুৎ উৎপন্ন হয় এবং পার্শ্ব উৎপন্ন পদার্থ হিসেবে পানি ও তাপ উৎপন্ন হয়।
PEM (Proton Exchange Membrane) ফুয়েল সেল একটি বৈদ্যুতিন ডিভাইস যা রাসায়নিক শক্তিকে বৈদ্যুতিন শক্তিতে রূপান্তরিত করে, মূলত হাইড্রোজেন এবং অক্সিজেনের মধ্যে রাসায়নিক প্রতিক্রিয়া থেকে। এই ফুয়েল সেলটি পরিবেশবান্ধব এবং উচ্চ কার্যকারিতা সম্পন্ন প্রযুক্তি হিসেবে পরিচিত, যা প্রধানত পরিবহন এবং শক্তির প্রযোজনে ব্যবহৃত হয়। PEM ফুয়েল সেলের প্রধান কাজ হল প্রোটন এক্সচেঞ্জ মেমব্রেনের মাধ্যমে হাইড্রোজেন আণু থেকে প্রোটন আলাদা করা এবং একে অক্সিজেনের সাথে প্রতিক্রিয়া ঘটিয়ে বিদ্যুৎ উৎপন্ন করা।
PEM ফুয়েল সেলের কাজের পদ্ধতি
PEM ফুয়েল সেলের মূল উপাদান হলো প্রোটন এক্সচেঞ্জ মেমব্রেন (PEM), যা হাইড্রোজেন আণু থেকে প্রোটন আলাদা করে এবং অ্যানোড এবং ক্যাথোডের মধ্যে এই প্রোটনের প্রবাহ তৈরি করে। ফুয়েল সেলে দুটি প্রধান রিয়াকশন ঘটে:
- অ্যানোডে: হাইড্রোজেন গ্যাস (H₂) অ্যানোডের উপর প্রবাহিত হলে এটি প্রোটন (H⁺) এবং ইলেকট্রন (e⁻) এ বিভক্ত হয়। ইলেকট্রনগুলি বাহ্যিক সার্কিটের মাধ্যমে ক্যাথোডে পৌঁছায়।
- ক্যাথোডে: অক্সিজেন (O₂) গ্যাস ক্যাথোডে প্রবাহিত হলে এটি প্রোটন এবং ইলেকট্রনের সাথে যুক্ত হয়ে জল (H₂O) তৈরি করে।
PEM ফুয়েল সেলের উপকারিতা
- উচ্চ কার্যকারিতা: PEM ফুয়েল সেল দ্রুত রিস্পন্স এবং উচ্চ তাপমাত্রায় কার্যকরী হয়।
- পরিবেশবান্ধব: এটি শুধু জল উৎপন্ন করে, কোনো দূষণ বা ক্ষতিকর গ্যাস নিঃসরণ হয় না।
- কমপ্যাক্ট ডিজাইন: PEM ফুয়েল সেল তুলনামূলকভাবে ছোট এবং লাইটওয়েট, যা বিভিন্ন অ্যাপ্লিকেশনে ব্যবহার উপযোগী।
PEM ফুয়েল সেলের চ্যালেঞ্জ
- উচ্চ খরচ: হাইড্রোজেন উৎপাদন এবং স্টোরেজে উচ্চ খরচ থাকে, যা এই প্রযুক্তির ব্যাপক ব্যবহারে প্রতিবন্ধক হতে পারে।
- ক্যাটালিস্ট সমস্যা: এই সেলে ব্যবহৃত প্লাটিনাম ক্যাটালিস্টের দাম এবং এর কার্যকারিতা নিয়ে কিছু চ্যালেঞ্জ রয়েছে।
- হাইড্রোজেন স্টোরেজ: হাইড্রোজেন গ্যাসের নিরাপদ এবং কার্যকরী স্টোরেজ একটি বড় চ্যালেঞ্জ।
সারাংশ:
PEM ফুয়েল সেল একটি আধুনিক এবং পরিবেশবান্ধব শক্তি উৎপাদন প্রযুক্তি যা হাইড্রোজেন ও অক্সিজেনের প্রতিক্রিয়া থেকে বিদ্যুৎ উৎপন্ন করে। এটি পরিবহন এবং শক্তি সঞ্চালনে ব্যবহার উপযোগী হলেও কিছু চ্যালেঞ্জ যেমন উচ্চ খরচ এবং হাইড্রোজেন স্টোরেজ সমস্যার মুখোমুখি।
হাইড্রোজেন ফুয়েল সেল ও এর সুবিধা
হাইড্রোজেন ফুয়েল সেল কী?
হাইড্রোজেন ফুয়েল সেল এমন একটি ডিভাইস যা রাসায়নিক প্রতিক্রিয়া ব্যবহার করে বিদ্যুৎ উৎপন্ন করে। এই প্রতিক্রিয়ায় হাইড্রোজেন গ্যাস (H₂) অক্সিজেন (O₂) এর সাথে মিলিত হয়ে পানি (H₂O) উৎপন্ন করে এবং এই প্রক্রিয়া থেকে শক্তি উৎপন্ন হয়। এটি মূলত পরিবেশবান্ধব শক্তির উৎস হিসেবে ব্যবহৃত হচ্ছে।
হাইড্রোজেন ফুয়েল সেলের কাজের নীতি
হাইড্রোজেন ফুয়েল সেল একটি বিদ্যুৎ উৎপাদনকারী সিস্টেম যা গ্যাসের আণবিক শক্তি ব্যবহার করে বিদ্যুৎ উৎপন্ন করে। ফুয়েল সেলের মধ্যে দুটি মূল উপাদান থাকে:
- এনোড (Anode): এখানে হাইড্রোজেন গ্যাস ইলেকট্রনের মাধ্যমে আণবিক পরমাণু থেকে বৈদ্যুতিক শক্তি নির্গত করে।
- ক্যাথোড (Cathode): এখানে অক্সিজেন গ্যাস থেকে হাইড্রোক্সাইড আয়ন তৈরি হয়, যা পানির আণবিক শক্তির মাধ্যমে শক্তি উৎপন্ন করে।
এই সিস্টেমের মাধ্যমে একদিকে শক্তি উৎপাদিত হয়, অন্যদিকে পরিবেশে কোনো দূষণ ছড়ায় না।
হাইড্রোজেন ফুয়েল সেলের সুবিধা
- পরিবেশবান্ধব: হাইড্রোজেন ফুয়েল সেল ব্যবহার করে কোনো ধরনের তাপ বা দূষণ উপাদান সৃষ্টি হয় না। এর প্রধান বাই-প্রোডাক্ট হল পানি, যা পরিবেশের জন্য ক্ষতিকর নয়।
- উচ্চ দক্ষতা: ফুয়েল সেলগুলো তুলনামূলকভাবে ইঞ্জিনের তুলনায় বেশি দক্ষ, কারণ এতে তাপের পরিমাণ কম এবং শক্তির কার্যকারিতা বেশি থাকে।
- নবায়নযোগ্য শক্তি: হাইড্রোজেন একটি নবায়নযোগ্য শক্তি উৎস, কারণ এটি প্রাকৃতিক গ্যাস বা পানি থেকে সহজেই উৎপন্ন করা যায়।
- শক্তি সঞ্চয়: হাইড্রোজেন ফুয়েল সেল থেকে উৎপন্ন শক্তি সহজে সঞ্চয় করা যায়, যা দীর্ঘ সময় পর্যন্ত ব্যবহার করা যায়।
- কম্প্যাক্ট ও পরিবহনযোগ্য: হাইড্রোজেন ফুয়েল সেল সহজে পরিবহনযোগ্য এবং কম্প্যাক্ট, তাই এটি বিভিন্ন জায়গায় ব্যবহার করা যেতে পারে।
সারাংশ
হাইড্রোজেন ফুয়েল সেল একটি পরিবেশবান্ধব এবং শক্তি দক্ষ প্রযুক্তি, যা বিদ্যুৎ উৎপাদন করতে অত্যন্ত কার্যকর। এটি দূষণ মুক্ত এবং নবায়নযোগ্য শক্তির উৎস হিসেবে গুরুত্বপূর্ণ ভূমিকা পালন করতে সক্ষম।
pH মিটার হলো কোন দ্রবণের প্রকৃতি( অম্লীয় না ক্ষারীয় বা প্রশম) এবং অম্লীয় ও ক্ষারীয় মাত্রা পরিমা্পক যন্ত্র।
কোন দ্রবণের- pH <7 হলে এটি অম্লীয় ; pH =7 হলে এটি প্রশম ; pH >7 হলে এটি ক্ষারীয় প্রকৃতির হয়।
কোন দ্রবণে বিদ্যমাব হাইড্রোজেন আয়নের মোলার ঘনমাত্রার ঋণাত্মক লগারিদমের মান কে pH বলে।
pH=-log[H^+]
# বহুনির্বাচনী প্রশ্ন
Read more